একটি আদর্শ গ্যাসের ক্ষেত্রে CP ও CV-এর মধ্যে পার্থক্য | Difference between CP and CV for an ideal gas
একটি আদর্শ গ্যাসের দুই আপেক্ষিক তাপের(Difference between CP and CV) মধ্যে পার্থক্য করতে গিয়ে তাপ কুপরিবাহী পদার্থের একটি আবদ্ধ চোঙ লই। মনে করি চোঙ C। চোঙের মধ্যে একটি হালকা ঘর্ষণশূন্য ও বায়ুনিরুদ্ধ পিস্টন বিনা বাধায় চলাচল করতে পারে। মনে করি পিস্টনটি D। পিস্টনটিও কুপরিবাহী পদার্থের তৈরি।
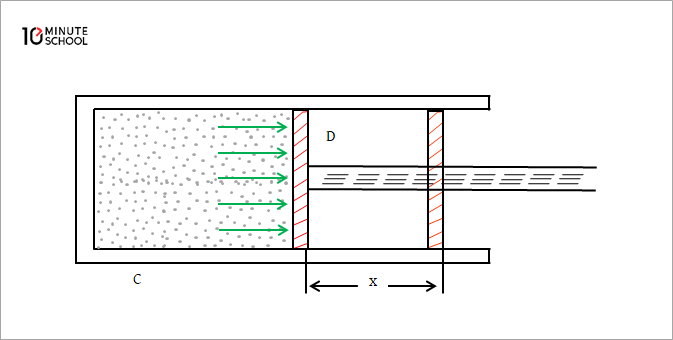
এই আবদ্ধ চোঙে 1 মোল পরিমাণ গ্যাস লই। এখন গ্যাসটির আয়তন স্থির রেখে এর তাপমাত্রা dT পরিমাণ বৃদ্ধি করি। যদি স্থির আয়তনে গ্যাসের আপেক্ষিক তাপ C_V হয়, তবে গ্যাস কর্তৃক গৃহীত তাপ
= ভর \times আপেক্ষিক তাপ \times তাপমাত্রার পার্থক্য
= 1\times C_V \times dT
=C_VdT
গ্যাসের তাপমাত্রা বৃদ্ধির পরিমাণ এক কেলভিন হলে গ্যাস কর্তৃক গৃহীত তাপ
=C_V\times 1
=C_V জুল (J)
মনে করি স্থির চাপে গ্যাসের আপেক্ষিক তাপ C_P অর্থাৎ স্থির চাপে 1 মোল গ্যাসের তাপমাত্রা 1 ডিগ্রি বাড়াতে C_P পরিমাণ তাপের প্রয়োজন হবে। গ্যাসে সরবরাহকৃত এই তাপ দুই ভাগে ব্যয়িত হবে। এর একটি অংশ C_V গ্যাসের তাপমাত্রা বাড়াবে এবং অপর অংশ বাহ্যিক চাপ P-এর বিরুদ্ধে গ্যাসের আয়তন বৃদ্ধিতে কাজ করবে। ধরি চাপের বিরুদ্ধে গ্যাসের আয়তন বৃদ্ধির ফলে পিস্টনটি x পরিমাণ দূরত্ব বাইরে সরে গেল। অতএব কাজের পরিমাণ = বল \times সরণ
= চাপ \times ক্ষেত্রফল \times সরণ [∵ বল = চাপ \times আয়তন]
=P \times A \times x[k; এখানে A= পিস্টন বা চোঙের প্রস্থচ্ছেদের ক্ষেত্রফল
∴ কাজ =P.dV জুল J; এখানে dV= গ্যাসের প্রসারিত আয়তন =A.x
অতএব, C_P=C_V+কাজের পরিমাণ
বা, C_P=C_V+P.dV —————- (1.6)
আমরা জানি আদর্শ গ্যাসের(Ideal Gas) ক্ষেত্রে
যদি চাপ স্থির থাকে, তবে সমীকরণ 1.16– কে ব্যবকলন করে পাই,
PdV+VdP=RdT+TdR
PdV+V\times 0=RdT+T\times 0———— [∵ স্থির চাপে dP=0 এবং R ধ্রুব রাশি হওয়ায়, dR=0 এবং তাপমাত্রা বৃদ্ধি dT=1K]
বা, PdV=RdT=R
∴ সমীকরণ 1.6 হতে পাই,
C_P=C_V+RC_P-C_V=R —————————- (1.7)
অর্থাৎ গ্যাসের দুই আপেক্ষিক তাপের পার্থক্য(Difference between CP and CV for an ideal gas) বা অন্তরফল গ্যাস ধ্রুবক R-এর সমান।
যেহেতু R ধনাত্মক, সুতরাং C_P>C_V। অর্থাৎ স্থির চাপে গ্যাসের মোলার আপেক্ষিক তাপ স্থির আয়তনে গ্যাসের মোলার আপেক্ষিক তাপ অপেক্ষা বড়। R-এর মান 8.314 JK^{-1}mol^{-1} বসিয়ে সমীকরণ (1.7) হতে পাওয়া যায়,C_P-C_V=8.314 J K^{-1}mol^{-1}
সমীকরণ (1.16) থেকে পাই, \frac{C_P}{C_V}-1=\frac{R}{C_V}
বা, \gamma -1 =\frac{R}{C_V} \Big(\because \frac{C_P}{C_V}=\gamma \Big)
বা, C_V=\frac{R}{\gamma -1}
