পদার্থের আন্তঃআণবিক বল
পদার্থের আন্তঃআণবিক বল (Intermolecular Forces of Matter)
বিভিন্ন পরমাণুর মধ্যে ক্রিয়াশীল বলের জন্য গঠিত হয় অণু আর বিভিন্ন অণুর মধ্যে ক্রিয়াশীল বলের জন্য গঠিত হয় পদার্থ । অণুগুলোর পরস্পরের মধ্যে যে বল ক্রিয়া করে তাকে বলা হয় আন্তঃআণবিক বল । এ আন্তঃআণবিক বল সৃষ্টি হয় দুটি শক্তির দরুন−
(ক) পারিপার্শ্বিক অণুগুলোর ক্রিয়া প্রতিক্রিয়ার ফলে সৃষ্ট বিভব শক্তি ।
(খ) অণুগুলোর তাপীয় শক্তি যা প্রকৃতপক্ষে অণুগুলোর গতিশক্তি । এ শক্তি বস্তুর উষ্ণতার উপর নির্ভরশীল ।
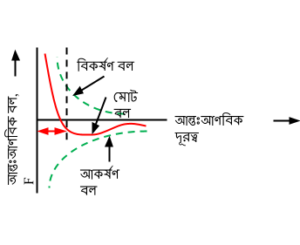
অণুগুলোর মধ্যকার দূরত্ব r-এর পরিবর্তনের সাথে আন্তঃআণবিক বলের পরিবর্তন ঘটে । এ পরিবর্তনের প্রকৃতি চিত্রে দেখানো হলো । আন্তঃআণবিক দূরত্ব যত বেশি হবে অর্থাৎ r যত বৃদ্ধি পাবে আন্তঃআণবিক বল তত আকর্ষণধর্মী হবে । আন্তঃআণবিক দূরত্ব r যত কম হবে আন্তঃআণবিক বল তত বিকর্ষণধর্মী হবে । স্বাভাবিক অবস্থায় আকর্ষণ ও বিকর্ষণ বল পরস্পরকে নিষ্ক্রিয় করে ফলে নিট বল শূন্য হয় । এ অবস্থায় r = r_{0} । এখানে r_{0} সাম্যাবস্থায় আন্তঃআণবিক দূরত্ব বা সুস্থিতি দূরত্ব (equilibrium distance) ।
পদার্থের তিন অবস্থা : কঠিন, তরল ও বায়বীয় (States of Matter : Solid, Liquid and Gas)
পদার্থ সাধারণত তিন অবস্থায় থাকে- কঠিন, তরল ও বায়বীয় অবস্থা । আন্তঃআণবিক দূরত্ব ও বল দিয়ে এ অবস্থার বর্ণনা করা যেতে পারে । যখন আন্তঃআণবিক দূরত্ব r = r_{0} তখন নিট বল শূন্য, তখন অণুগুলো সাম্যাবস্থায় অবস্থান করে । সাম্যাবস্থায় অণুগুলো একটি নিয়মিত ত্রিমাত্রিক বিন্যাসে সজ্জিত থাকে যাদের বলা হয় কেলাস । অণু বা আয়নগুলো দ্বারা দখল করা অবস্থানকে বলা হয় ল্যাটিস বিন্দু । সামান্য টেনে অণুগুলোকে যখন এদের পরস্পর থেকে কিছুটা দূরে নেওয়া হয় অর্থাৎ যখন r>r_{0} তখন অণুগুলোর মধ্যে আকর্ষণ বল কাজ করে । অণুগুলোকে যদি কিছু ঠেলে আরও কাছাকাছি আনা হয় অর্থাৎ যদি r<r_{0} হয়, একটি বিকর্ষণ বল কাজ করে । এভাবে কোনো অণুকে যদি এর সাম্যাবস্থা থেকে সরানো হয় তাহলে এটা এর গড় অবস্থানকে ঘিরে স্পন্দিত হতে থাকবে । কঠিন পদার্থে এরকম অবস্থা থাকে । কঠিন পদার্থে অণুগুলো থাকে প্রায় সাম্যাবস্থার দূরত্বে । স্পন্দনের বিস্তার খুব কম হয় ফলে অণুগুলো এদের অবস্থানে আবদ্ধ থাকে । কঠিন পদার্থের নির্দিষ্ট আকার কেন থাকে তার ব্যাখ্যা এ থেকে পাওয়া যায়। সুতরাং বলা যায় যে,
১. কঠিন পদার্থে অণুগুলো খুব কাছাকাছি থাকে এবং সুদৃঢ় বিন্যাসে সজ্জিত থাকে ।
২. কঠিন পদার্থে অণুগুলো এদের গড় অবস্থানকে ঘিরে স্পন্দিত হয় ।
৩. কঠিন পদার্থে অণুগুলোর মধ্যবর্তী বল প্রবল ।
৪. কঠিন পদার্থের নির্দিষ্ট আকার আছে ।
তরল পদার্থ (Liquid Matter) : তরল পদার্থে অণুগুলোর মধ্যবর্তী গড় দূরত্ব কঠিন পদার্থের চেয়ে কিছুটা বেশি । এদের মধ্যে আকর্ষণ বল দুর্বল এবং অণুগুলো মুক্তভাবে তরল পদার্থের সর্বত্র ঘুরে বেড়াতে পারে । ফলে তরল পদার্থের আকার পরিবর্তিত হয় এবং যে পাত্রে রাখা হয় তার আকার ধারণ করে ।
বায়বীয় পদার্থ (Gaseous Matter) : বায়বীয় পদার্থ বা গ্যাসের বেলাতে অণুগুলোর আকৃতির তুলনায় এদের মধ্যবর্তী দূরত্ব খুব বেশি অর্থাৎ r \gg r_{0} । ফলে আন্তঃআণবিক বল খুব দুর্বল বা নগণ্য । এ পদার্থের অণুগুলো ইতস্তত বিক্ষিপ্ত গতিতে থাকে । অণুগুলোর কোনো নির্দিষ্ট বিন্যাস থাকে না । অণুগুলো পরস্পরের সাথে এবং ধারক পাত্রের দেয়ালের সাথে স্থিতিস্থাপক সংঘর্ষ ঘটায় । সংঘর্ষের সময় ছাড়া অণুগুলোর মধ্যবর্তী বল নগণ্য ।
পদার্থের বন্ধন (Bonds of Matter)
সকল পদার্থেরই অণু গঠিত হয় বন্ধন গঠনের মাধ্যমে । মৌল যখন পারমাণবিক অবস্থায় থাকে, তখন তা অস্থিতিশীল অবস্থায় থাকে । ফলে এর জন্য বিপুল বিভব শক্তির প্রয়োজন হয় । কিন্তু বন্ধন দ্বারা গঠিত অণুতে পরমাণু স্থিতিশীল অবস্থায় থাকে, তখন এর বিভব শক্তি থাকে খুবই কম । সুতরাং পরমাণুগুলোর সংযোগের ফলে যখন ব্যবস্থার বিভব শক্তি হ্রাস পায় পরমাণুগুলোর মধ্যে তখন বন্ধন বা রাসায়নিক বন্ধন গঠিত হয় ।
বন্ধন বিভিন্ন প্রকার হতে পারে; যেমন-
১। আয়নিক বন্ধন (Ionic Bond)
২। সমযোজী বন্ধন (Covalent Bond)
৩। ধাতব বন্ধন (Metallic Bond) এবং
৪। ভ্যানডার ওয়ালস বন্ধন (Vander Waals Bond)
আয়নিক বন্ধন (Ionic Bond)
কোনো কঠিন পদার্থে অণু বা আয়নগুলো যে অবস্থান দখল করে থাকে, তাকে বলা হয় ল্যাটিস বিন্দু । আয়নিক বন্ধনে ধনাত্মক ও ঋণাত্মক আয়ন ল্যাটিস বিন্দু দখল করে থাকে । এসব আয়নের মধ্যকার স্থির তড়িৎ আকর্ষণ আয়নিক বা তড়িৎযোজী বন্ধন তৈরি করে । এ আকর্ষণ বল খুবই প্রবল । সুতরাং এ বন্ধনে তৈরি পদার্থ খুবই শক্ত এবং এদের গলনাঙ্কও বেশি । এসব পদার্থের তড়িৎ পরিবাহিতা খুব কম । আয়নিক বন্ধন দ্বারা যে পদার্থ তৈরি হয় তাদের বলা হয় আয়নিক কঠিন পদার্থ । আয়নিক বন্ধন কখনো দুটি অধাতু পরমাণু বা দুটি ধাতু পরমাণুর মধ্যে গঠিত হয় না । দুটি বিপরীতধর্মী মৌল যেমন : ধাতু ও অধাতুর মধ্যে সৃষ্ট আয়নিক বন্ধন দ্বারা যৌগ গঠিত হয় । এ ধরনের যৌগ হলো সোডিয়াম ক্লোরাইড । সোডিয়াম ও ক্লোরিনের পরমাণু সমন্বয়ে সোডিয়াম ক্লোরাইড গঠিত হয় । চিত্রে সোডিয়াম ক্লোরাইডের আয়নিক বন্ধন দেখানো হয়েছে।

সমযোজী বন্ধন (Covalent Bond)
একই বা ভিন্ন দুটি অধাতুর পরমাণুর মধ্যে সমযোজী বন্ধন গঠিত হয় । পারিপার্শ্বিক পরমাণুগুলো পরস্পরের সাথে ইলেকট্রন শেয়ার করে এই বন্ধন তৈরি করে । এ রকম সমযোজী বন্ধন কোনো স্থানে বিস্তৃত হয়ে কঠিন পদার্থের বৃহৎ কাঠামো তৈরি করে । সিলিকন ইত্যাদি সমযোজী কঠিন পদার্থের উদাহরণ । হীরক গঠনে প্রতিটি কার্বন পরমাণু পারিপার্শ্বিক চারটি কার্বন পরমাণুর সাথে বন্ধন তৈরি করে । এরা যথেষ্ট শক্ত, উচ্চ গলনাঙ্কবিশিষ্ট এবং তড়িৎ কুপরিবাহী। চিত্রে জার্মেনিয়ামের সমযোজী বন্ধন দেখানো হয়েছে ।

পরমাণুতে একটিমাত্র ইলেকট্রন থাকায় হাইড্রোজেন পরমাণু সাধারণ সমযোজী বন্ধনে অংশ নিয়ে থাকে । দুটো হাইড্রোজেন পরমাণু একটি করে ইলেকট্রন প্রদান করে একটি ইলেকট্রন যুগল সমযোজী বন্ধন গঠনের মাধ্যমে হাইড্রোজেন অণুর সৃষ্টি করে । সাধারণভাবে সমযোজী বন্ধন দ্বারা গঠিত যৌগ তড়িৎ দ্বিমেরুর ন্যায় আচরণ করে । এরকম কয়েকটি দ্বিমেরু স্থির বৈদ্যুতিক আকর্ষণের ফলে এরা বন্ধনে আবদ্ধ হয় । এসব দ্বিমেরু বন্ধনে হাইড্রোজেনের তড়িৎ ঋণাত্মকতা খুব কম হওয়ায় ধনাত্মক প্রান্ত হিসেবে কাজ করে । যখন এরূপ দ্বিমেরুসমূহ পরস্পরের কাছে আসে তখন একটি অণুর হাইড্রোজেন প্রান্ত অন্য অণুর ঋণাত্মক প্রান্তের দিকে বিশেষভাবে আকর্ষিত হয়ে বন্ধন গঠন করে । স্থির তড়িতের মধ্যকার কুলম্ব বলের কারণে সৃষ্ট এ বন্ধনকে হাইড্রোজেন বন্ধন বলে ।
হাইড্রোজেন ফ্লোরাইড, হাইড্রোজেন সায়ানাইড, অ্যামোনিয়াম ফ্লোরাইড, বরফ (\mathrm{H}_{2} \mathrm{O}) ইত্যাদি হাইড্রাজেন বন্ধন কেলাসের উদাহরণ । সমযোজী অণুর সমযোজী বন্ধন অপেক্ষা হাইড্রোজেন বন্ধন অনেক দুর্বল তাই একে সত্যিকার অর্থে রাসায়নিক বন্ধন বলা যায় না ।
ধাতব বন্ধন (Metallic Bond)
কোনো ধাতুর মধ্যে যে আকর্ষণ বল পরমাণুগুলোকে পরস্পরের সাথে আটকে রাখে তাকে ধাতব বন্ধন বলা হয় । ধাতুতে ল্যাটিস বিন্দুতে ধনাত্মক আয়ন থাকে । এ আয়ন উপাদানিক পরমাণু থেকে এক বা একাধিক ইলেকট্রনকে আলাদা করে তৈরি হয় । এসব ইলেকট্রন অত্যন্ত সচল এবং ধাতব কঠিন পদার্থের সর্বত্র গ্যাসের অণুর মতো ঘুরে বেড়ায় । এ ইলেকট্রনগুলো কোনো পরমাণুর থাকে না বরং সমগ্র বস্তুখণ্ডের অংশ হয়ে যায় । ধাতুতে পরমাণুগুলো ইলেকট্রন হারিয়ে ধনাত্মক আধানে আহিত আয়নে রূপান্তরিত হয় এবং একটি ত্রিমাত্রিক ল্যাটিসে বিন্যস্ত হয় । এ যেন ইলেকট্রনের সমুদ্রে ডুবন্ত ধাতব আয়ন । মুক্ত ইলেকট্রন থাকার কারণে ধাতু তড়িৎ সুপরিবাহী । চিত্রে সোডিয়ামের ধাতব বন্ধন দেখানো হয়েছে ।

ভ্যানডার ওয়ালস বন্ধন (Vander Waals Bond)
ভ্যানডার ওয়ালস বন্ধন দ্বারা আণবিক কঠিন পদার্থ তৈরি হয় । পরমাণুগুলোর মধ্যে সমযোজী বন্ধনের মাধ্যমে এ ধরনের কঠিন পদার্থ তৈরি হয় । অণুগুলোর মধ্যে বন্ধন নির্ভর করে অণুগুলো পোলার (Polar) বা অ-পোলার (non-polar) কিনা তার উপর । কোনো অণুর ঋণাত্মক আধানের কেন্দ্র যদি ধনাত্মক আধানের সাথে সমাপতিত হয় তাহলে অণুটিকে বলা হয় অ-পোলার ।
সকল নিষ্ক্রয় গ্যাস, হাইড্রোজেন, নাইট্রোজেন, কার্বন ডাই অক্সাইডের অক্সিজেন অণুগুলো এ ধরনের অণু । অন্যথায়, অণুটিকে বলা হয় পোলার অণু । পানি, অ্যামোনিয়া, সালফার ডাই অক্সাইডের অণু হলো পোলার অণু । পোলার অণুগুলোর মধ্যকার বন্ধনকে বলা হয় দ্বিপোল-দ্বিপোল বন্ধন । অ-পোলার অণুগুলোর মধ্যকার বন্ধনকে বলা হয় ভ্যানডার ওয়ালস বন্ধন । আর্গন কেলাসের ভ্যানডার ওয়ালস বন্ধন দেখানো হয়েছে । যে বল ভ্যানডার ওয়ালস বন্ধন সৃষ্টি করে তাকে ভ্যানডার ওয়ালস বলও বলা হয় ।
আণবিক কঠিন পদার্থ সাধারণত নরম এবং নিম্ন গলনাঙ্কবিশিষ্ট হয় । এরা তড়িৎ কুপরিবাহী ।
