পদার্থের অবস্থা ও কণার গতিতত্ত্ব (State of Matter and Kinetic Theory of Particles)
পদার্থ (Matters)
পদার্থ অণু এবং পরমাণু দিয়ে গঠিত। বিভিন্ন পরমাণুর মধ্যে ক্রিয়াশীল বলের জন্য গঠিত হয় অণু আর বিভিন্ন অণুর মধ্যে ক্রিয়াশীল বলের জন্য গঠিত হয় পদার্থ।
সুতরাং, পদার্থ বলতে বুঝায় যার নির্দিষ্ট ভর আছে এবং যে জায়গা দখল করে।
পদার্থের প্রকারভেদ (Classification of Matters)
 কঠিন পদার্থ (Solids)
কঠিন পদার্থ (Solids)
- কঠিন পদার্থের নির্দিষ্ট ভর,আকার ও আয়তন আছে।
- কঠিন পদার্থে অণুগুলো খুব কাছাকাছি অবস্থান করে এবং সুদৃঢ় বিন্যাসে সজ্জিত থাকে।
- কঠিন পদার্থের কণাগুলোর মধ্যে এক ধরনের আকর্ষণ বল কাজ করে যাকে বলা হয় আন্তঃআণবিক আকর্ষণ বল।
- কঠিন পদার্থের অণুগুলো এদের গড় অবস্থানকে ঘিরে স্পন্দিত হয়।
- কঠিন পদার্থের অণুগুলোর মধ্যবর্তী বল প্রবল।
- চাপ প্রয়োগ করলে কঠিন পদার্থের অণুগুলো সংকুচিত হয় না। [অণু, পরমাণু বা আয়ন]
- তাপমাত্রা বাড়ালে কঠিন পদার্থের আয়তন খুবই কম পরিমাণে বৃদ্ধি পায়।
- কোনো কোনো কঠিন পদার্থকে তাপ দিলে তরলে পরিণত না হয়ে সরাসরি বাষ্পে পরিণত হয়। যেমন: ন্যাপথালিন।
তরল পদার্থ (Liquids)
- নির্দিষ্ট ভর ও নির্দিষ্ট আয়তন থাকে।
- নির্দিষ্ট কোনো আকার নেই।
- তরল পদার্থের অণুগুলোর গড় দুরত্ব কঠিন পদার্থের চেয়ে কিছুটা বেশি।
- মধ্যবর্তী আকর্ষণ বল দুর্বল।
- অণুগুলো মুক্তভাবে তরল পদার্থের সর্বত্র ঘুরে বেড়াতে পারে।
- তরল পদার্থকে যে পাত্রে রাখা হয়, সে পাত্রের আকার ধারণ করে।
- চাপ প্রয়োগ করলে তরল পদার্থের আয়তন হ্রাস পায় না।
- তাপ প্রয়োগ করলে তরল পদার্থের আয়তন বৃদ্ধি পায় এবং আয়তন বৃদ্ধির পরিমাণ কঠিন পদার্থের থেকে বেশি।
- তরল পদার্থ তৈরি হয় অনবরত কম্পনশীল অণুর মাধ্যমে। এতে অণুগুলো আন্তঃআণবিক বন্ধনের মাধ্যমে পরস্পরের কাছাকাছি থাকে।
- অধিকাংশ তরলই সংকুচিত হতে চায় না। তবে কিছু কিছু তরল সংকুচিত হয়।
- তরল প্রবাহিত হতে পারে। একে প্রবাহী পদার্থ বা ফ্লুইড বলে। উদাহরণ: পানি, দুধ, তেল।
Extra: Ethanol, Household Bleach, Blood, Gasoline, Acetone and Butyl Alcohol.
বায়বীয় পদার্থ (Gases)
- গ্যাসীয় পদার্থের নির্দিষ্ট ভর আছে।
- নির্দিষ্ট আকার কিংবা আয়তন নেই।
- কোনো পাত্রে রাখলে সে পাত্রের পুরো আয়তন দখল করে।
- গ্যাসীয় পদার্থের অণুগুলোর আকৃতির তুলনায় এদের মধ্যবর্তী দূরত্ব খুব বেশি।
- এদের আন্তঃআণবিক আকর্ষণ বল খুব দুর্বল বা নগণ্য।
- এ পদার্থের অণুগুলোর কোনো নির্দিষ্ট বিন্যাস থাকে না।
- অণুগুলো ইতস্ততঃ বিক্ষিপ্ত গতিতে থাকে।
- সামান্য চাপ প্রয়োগ করলে গ্যাসীয় পদার্থের আয়তন অনেক কমে যায়।
- তাপ প্রয়োগ করলে আয়তন অনেক বেড়ে যায়।
- অণুগুলো অধিক দূরত্বে অবস্থান করে।
- অণুগুলো পরস্পরের সাথে এবং ধারক পাত্রের দেয়ালের সাথে স্থিতিস্থাপক সংঘর্ষ ঘটায়। সংঘর্ষের সময় ছাড়া অণুগুলোর মধ্যবর্তী বল নগণ্য।
- বায়বীয় পদার্থকে ঠান্ডা করলে তরলে পরিণত হয়।
- ছোট পাত্রে এর আয়তন অনেক কম কিন্তু বড় পাত্রে আয়তন বেশি।
- উচ্চ তাপীয় দশায় কঠিন ও তরল পদার্থ বায়বীয় পদার্থে পরিণত হয়।
- মুক্ত পরিবেশে বায়বীয় পদার্থের কণাগুলো বন্ধনহীনভাবে চারদিকে ছড়িয়ে পড়ে। উদাহরণ: অক্সিজেন, হাইড্রোজেন, নাইট্রোজেন, বাতাস।

সংক্ষিপ্ত ব্যাখ্যা (Brief explanation):

কণার গতিতত্ত্ব (Kinetic Theory of Particles)
সংজ্ঞা (Definition): আন্তঃকণা আকর্ষণ শক্তি এবং কণাগুলোর গতিশক্তি দিয়ে পদার্থের কঠিন, তরল ও গ্যাসীয় অবস্থা ব্যাখ্যা করার তত্ত্বকেই কণার গতিতত্ত্ব বলা হয়।
- কঠিন অবস্থায় কণাগুলো খুব কাছাকাছি অবস্থান করে যার ফলে কণাগুলোর ভেতরকার আকর্ষণ শক্তি বেশি থাকে এবং নিজেদের অবস্থান থেকে নড়তে পারে না।
- যদি তাপ আরও বেশি দেওয়া হয় তাহলে কণাগুলো তাপশক্তি গ্রহণ করে কাঁপতে থাকে এবং আন্তঃআণবিক শক্তি কিছুটা কমে যায়। এই অবস্থাকে তরল অবস্থা বলে।
- যদি তরল অবস্থায় আরও বেশি তাপ দেওয়া হয়, তখন কণাগুলোর আন্তঃআণবিক শক্তি আরও কমে যায় এবং একটি কণা অপর একটি কণা থেকে অধিক দূরত্বে অবস্থান করে। একে বায়বীয় অবস্থা বলে।
ব্যাপন (Diffusion
সংজ্ঞা (Definition): কোনো মাধ্যমে কঠিন, তরল বা বায়বীয় বস্তুর স্বতঃস্ফূর্ত ও সমভাবে পরিব্যাপ্ত হওয়ার প্রক্রিয়াই হলো ব্যাপন।
- আন্তঃআণবিক আকর্ষণ তথা ঘনত্ব কম হলে ব্যাপন দ্রুত হয়।
- তাপমাত্রা বাড়লে ও বস্তুর আন্তঃকণা আকর্ষণ কমে গিয়ে ব্যাপন হার বেড়ে যায়।
- আণবিক ভর বেশি হলে ব্যাপন কম হয়।
নিঃসরণ (Effusion)
সরু ছিদ্রপথে কোনো গ্যাসের অণুসমূহের উচ্চচাপ থেকে নিম্নচাপ অঞ্চলে বেরিয়ে আসার প্রক্রিয়াকে নিঃসরণ বলে। উদাহরণ (Example): গাড়ির চাকা, গ্যাস বেলুন।
ব্যাখ্যা (Explanation): গাড়ির চাকার টিউব ফুটো করে দিলে টিউবের ছিদ্রপথে নিঃসরণ প্রক্রিয়ায় বাতাস বের হয়ে পড়ে।
Note: নিঃসরণে অণুসমূহের বেগ ব্যাপনের অণুসমূহের বেগের তুলনায় অনেক বেশি।
নিঃসরণে চাপের প্রভাব বেশি। বাহ্যিক উচ্চ চাপের কারণে পাত্রের সরু ছিদ্র পথ দিয়ে গ্যাস সজোরে বের হয়।
বিভিন্ন গ্যাসে নিঃসরণের ব্যাখ্যা (Explanation of Effusion of Different Gases):
মিথেন (CH_4) → আণবিক ভর 16
অক্সিজেন (O_2) → আণবিক ভর 32
বিউটেন (C_4H_{10}) → আণবিক ভর 58
প্রোপেন (C_3H_8) → আণবিক ভর 44
এখানে, মিথেন গ্যাসের ভর সবথেকে কম। তাই নির্দিষ্ট চাপে এই গ্যাসের ঘনত্বও সবচেয়ে কম। মিথেন গ্যাসের ভর ও ঘনত্ব সবচেয়ে কম হওয়ায় এর নিঃসরণ সবচেয়ে বেশি হবে।

গলনাংক ও স্ফুটনাংক (Melting Point and Boiling Point)
গলনাংক (Melting Point): স্বাভাবিক চাপে (1 atm) যে তাপমাত্রায় কোনো কঠিন পদার্থ তরলে পরিণত হয় সেই তাপমাত্রাকেই ঐ পদার্থের গলনাংক বলে।
প্রত্যেক বিশুদ্ধ কঠিন পদার্থের গলনাংক থাকে।
১ বায়ুমন্ডলীয় চাপে বরফের গলনাংক 0 ডিগ্রি সেলসিয়াসের খুব কাছে (৩২ ডিগ্রি ফারেনহাইট, ২৭৩.১৬ কেলভিন)। তবে টাংস্টেনের গলনাংক সবথেকে বেশি, ৩৪১০ ডিগ্রি সেলসিয়াস (৩৬৮৩ কেলভিন)। এজন্য লাইট বাল্বে টাংস্টেন ব্যবহার করা হয়।
এছাড়াও পদার্থকে তাপ প্রয়োগ করলে এর তাপমাত্রা বাড়তে থাকে। কিন্তু গলনাংকে পৌঁছানোর পর তাপ প্রয়োগ করা সত্ত্বেও তাপমাত্রা বৃদ্ধি পাবে না। সম্পূর্ণ পদার্থ গলে তরলে পরিণত হয়ে যাওয়ার পর আবার তাপমাত্রা বৃদ্ধি পেতে থাকবে।
অর্থাৎ, গলন প্রক্রিয়ার সময় তাপমাত্রার কোনো বৃদ্ধি ঘটে না।
Extra: পদার্থ যখন তরল থেকে কঠিনে পরিণত হয় তখন গলনাঙ্কের তাপমাত্রাকে হিমাঙ্ক বলে।
স্ফুটনাংক (Boiling Point): স্ফুটনাংক হলো এমন একটি তাপমাত্রা যাতে পৌঁছালে তরল পদার্থ বাষ্পে পরিণত হয়।
অর্থাৎ, যে তাপমাত্রায় কোনো তরল পদার্থের বাষ্পীয় চাপ এক বায়ুমন্ডলীয় (1 atm) চাপের সমান হয় এবং তরলটি বুদবুদ-সহ ফুটতে থাকে, তাকে সেই তরল পদার্থের স্ফুটনাংক বলে।
তাপ প্রয়োগের মাধ্যমে তরলের তাপমাত্রা বৃদ্ধি করতে থাকলে এক পর্যায়ে গিয়ে তাপ প্রয়োগ করলেও তাপমাত্রার কোনো পরিবর্তন হয় না।
অর্থাৎ, সম্পূর্ণ স্থির হয়ে যায়। একটি নির্দিষ্ট সময় সম্পূর্ণ তরল বাষ্পে রূপান্তর হওয়ার পর তাপমাত্রা আবার বৃদ্ধি পেতে শুরু করে। বায়ুশূন্য স্থানে তরলের স্ফুটনাংক কম থাকে। অধিক বায়ুচাপে স্ফুটনাংক বেড়ে যায়। এজন্য পাহাড়ের উপর পানি ফুটতে দেরি হয়। যেমন: ভূ-পৃষ্ঠে পানির স্ফুটনাংক ১০০ ডিগ্রী সেলসিয়াস, তবে হিমালয় পর্বতের উপরে এই স্ফুটনাংক মাত্র ৭১ ডিগ্রী সেলসিয়াস।
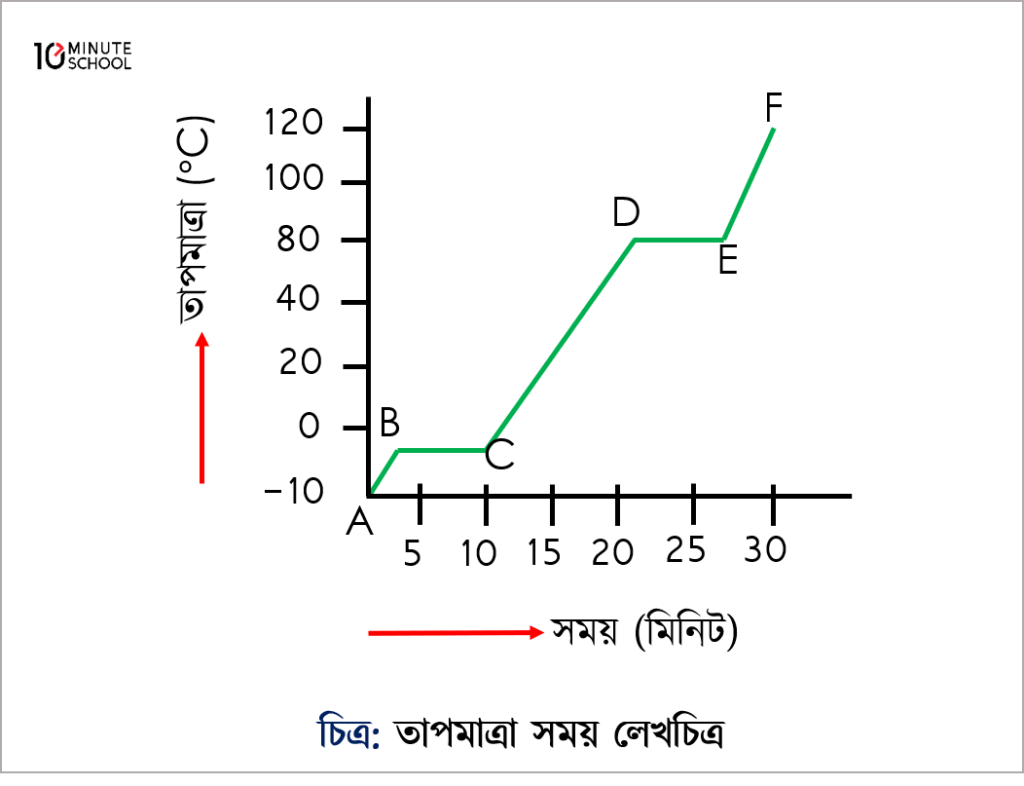
চিত্রে (-10°C) তাপমাত্রায় বরফ A বিন্দু দ্বারা চিহ্নিত করা হয়েছে। তাপ প্রদানের ফলে – 10°C তাপমাত্রায় বরফ 0°C তাপমাত্রার বরফে পরিণত হয়েছে। বরফের গলনাংক 0°C।
সুতরাং, বরফের গলনাংক B বিন্দু দ্বারা চিহ্নিত করা হয়েছে। 0°C তাপমাত্রার বরফ তাপ প্রদানের ফলে বরফ গলনের আপেক্ষিক সুপ্ততার গ্রহণ করে সম্পূর্ণ বরফ গলে 0°C তাপমাত্রার পানিতে পরিণত হয়েছে। এ অবস্থা লেখচিত্রের B – C দ্বারা চিহ্নিত করা হয়েছে। এখানে পানির অবস্থার পরিবর্তন হয়েছে । (কঠিন – তরল) 0°C তাপমাত্রার পানি তাপ প্রদানের ফলে তাপ গ্রহণে করে 100°C তাপমাত্রার পানিতে পরিণত হয়েছে। এ ঘটনাকে লেখচিত্রে C – D দ্বারা চিহ্নিত করা হয়েছে। পানির স্ফুটনাংক 100 ডিগ্রী সেলসিয়াস তাপমাত্রা।
সুতরাং পানির স্ফুটনাংক D বিন্দু দ্বারা চিহ্নিত করা হয়েছে।
100 ডিগ্রী সেলসিয়াস তাপমাত্রায় পানি তাপ প্রদানের ফলে পানির বাষ্পীকরণের আপেক্ষিক সুপ্ততাপ গ্রহণ করে সম্পূর্ণ পানি বাষ্পীভূত হয়ে 100 ডিগ্রী সেলসিয়াস তাপমাত্রার বাষ্পে পরিণত হয়েছে। এখানে পানির অবস্থার পরিবর্তন হয়েছে। (তরল – বাষ্প)
100 ডিগ্রী সেলসিয়াস তাপমাত্রার জলীয় বাষ্প তাপ প্রদানের ফলে 120 ডিগ্রী সেলসিয়াস তাপমাত্রার জলীয় বাষ্পে পরিণত হয়েছে। এ ঘটনাকে লেখচিত্রের E – F দ্বারা চিহ্নিত করা হয়েছে। লেখচিত্রে B – C ও D – E দ্বারা যথাক্রমে পদার্থের গলনাংক ও স্ফুটনাংককে নির্দেশ করা হয়েছে। এ দুটি স্থানে তাপমাত্রার কোনো পরিবর্তন হয় না অর্থাৎ তাপমাত্রা স্থির থাকে। যে তাপমাত্রায় কোনো কঠিন পদার্থ তরল পদার্থে রূপান্তরিত হয় সে তাপমাত্রাকে সেই পদার্থের গলনাংক বলা হয়।
পদার্থ গলনাঙ্কে পৌঁছালে তাকে যতই তাপ দেওয়া হোক না কেন তাপমাত্রা বাড়ে না। কারণ, তখন অতিরিক্ত তাপমাত্রা কঠিন পদার্থকে গলাতে ব্যবহৃত হয়। যতক্ষণ পর্যন্ত পদার্থের সকল অণু বিচ্ছিন্ন না হয় ততক্ষণ তাপমাত্রা স্থির থাকে। আবার, যে তাপমাত্রায় কোনো তরল পদার্থের বাষ্পীয় চাপ এক বায়ুমন্ডল চাপের সমান এবং তরল পদার্থটি বুদবুদসহ ফুটতে থাকে তাকে সেই তরলের স্ফুটনাংক বলা হয়। যখন তরল তার স্ফুটনাংকে পৌঁছায় তখনও তাপমাত্রা স্থির থাকে। যতক্ষণ না তরল পদার্থের অণুসমূহ সম্পূর্ণরূপে গ্যাসে পরিণত হচ্ছে ততক্ষণ পর্যন্ত তাপমাত্রার কোনো পরিবর্তন হয় না। অতিরিক্ত তাপশক্তি তরলের পরমাণুসমূহকে বিচ্ছিন্ন করতে ব্যয় হয়। এ তাপমাত্রাকে পানির বাষ্পীভবনের আপেক্ষিক সুপ্ততাপ বলে। আর এ কারণে লেখচিত্রে B – C ও D – E বরাবর তাপমাত্রার কোনো পরিবর্তন ঘটে না, স্থির থাকে।
NaCl এর শীতলীকরণের লেখচিত্র:
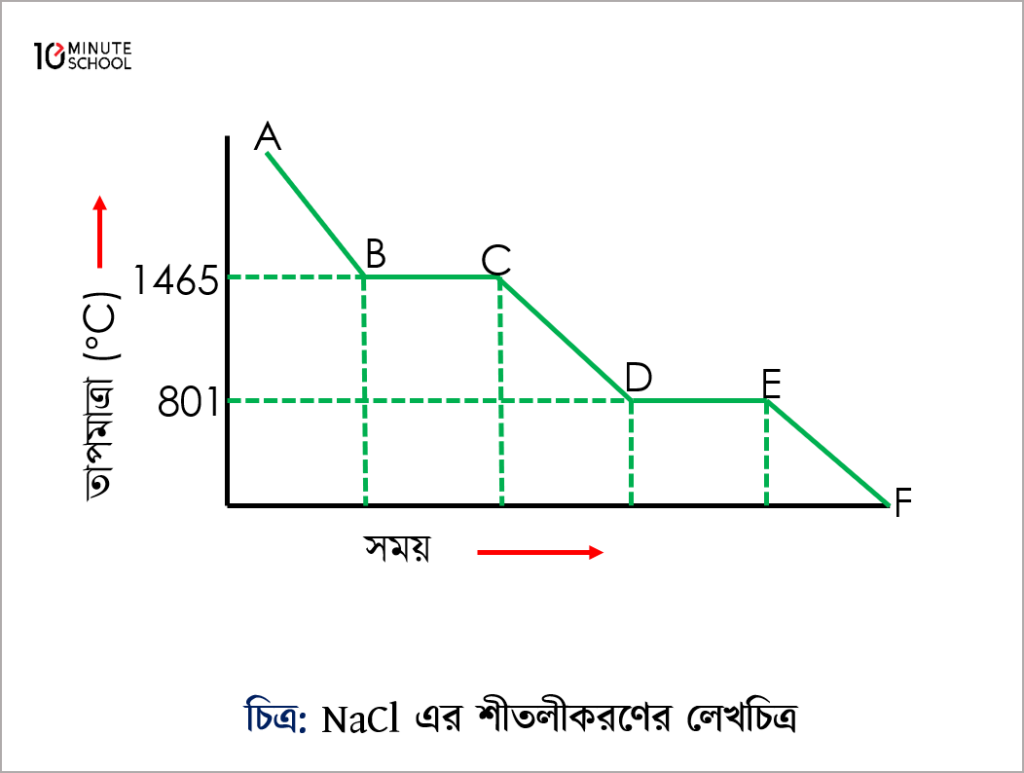
A বিন্দুতে NaCl গ্যাসীয় অবস্থায় বিদ্যমান থাকে। A থেকে B বিন্দুতে আসতে NaCl তাপ প্রদান করে তাপমাত্রা হারাতে থাকে। B বিন্দুতে NaCl এর ফুটন্ত অবস্থা নির্দেশ করে। কারণ আমরা জানি NaCl এর স্ফুটনাংক 1465°C । এক্ষেত্রে B বিন্দুতে আসার পর গ্যাস ও তরলের মধ্যে সাম্যাবস্থার সৃষ্টি হয়। সাম্যাবস্থায় থাকাকালে দ্রবণের তাপমাত্রার কোনো পরিবর্তন হয়না। তাপমাত্রা 1465°C এর নিচে নেমে আসলে গ্যাসীয় NaCl তরলে পরিণত হতে আরম্ভ করে। আবার তরল NaCl এর তাপমাত্রা আরো হ্রাস করলে D বিন্দুতে এসে তরল NaCl ও কঠিন NaCl এর মধ্যে সাম্যাবস্থার সৃষ্টি করে। ফলে D ও E বিন্দু পর্যন্ত তাপমাত্রা অপরিবর্তিত থাকে। এক্ষেত্রে B – C রেখা গ্যাসীয় ও তরল অবস্থা, C – D রেখা তরল অবস্থা, D – E রেখা তরল ও কঠিন অবস্থা নির্দেশ করে। এভাবেই তাপমাত্রা হ্রাসের সাথে NaCl এর B থেকে E বিন্দু পর্যন্ত অবস্থার পরিবর্তন ঘটে।
পাতন (Distillation)
তাপ প্রয়োগে কোনো তরলের বাষ্পে রূপান্তর ও শীতলীকরণে ঘনীভূত হয়ে একই তরল পদার্থে পরিণত হওয়ার প্রক্রিয়াকে পাতন বলে।
পাতন = তরলের বাষ্পীভবন + বাষ্পের ঘনীভবন
ঊর্ধ্বপাতন (Sublimation)
যেসব কঠিন পদার্থের গলনাংকের নিম্ন তাপমাত্রায় এদের বাষ্পচাপ বায়ুচাপ অপেক্ষা বেশি হয় সে সব কঠিন পদার্থ তাপের প্রভাবে কঠিন অবস্থা থেকে সরাসরি বাষ্পে পরিণত হয়, আবার ঐ বাষ্পকে শীতল করলে পূর্বের কঠিন পদার্থে পরিণত হয়। এ পদ্ধতিকেই উর্ধ্বপাতন বলে।

এ কঠিন পদার্থকে উর্ধ্বপাতনযোগ্য পদার্থ বলে। যেমন: কর্পূর, ন্যাপথালিন, বেনজয়িক এসিড।
উর্ধ্বপাতনে পৃথকীকৃত বস্তুকে উৎক্ষেপ (Saldimate) বলে।
উর্ধ্বপাতিত পদার্থসমূহ হলো (Sublimated Matters are):
১. নিশাদল (NH_4Cl)
২. কর্পূর (C_{10}H_{16}O)
৩. ন্যাপথালিন (C_{10}H_8)
৪. কঠিন কার্বন ডাই অক্সাইড (CO_2) (একে শুষ্ক বরফও বলা হয়)
৫. আয়োডিন (I_2)
৬. অ্যালুমিনিয়াম ট্রাই ক্লোরাইড (AlCl_3)
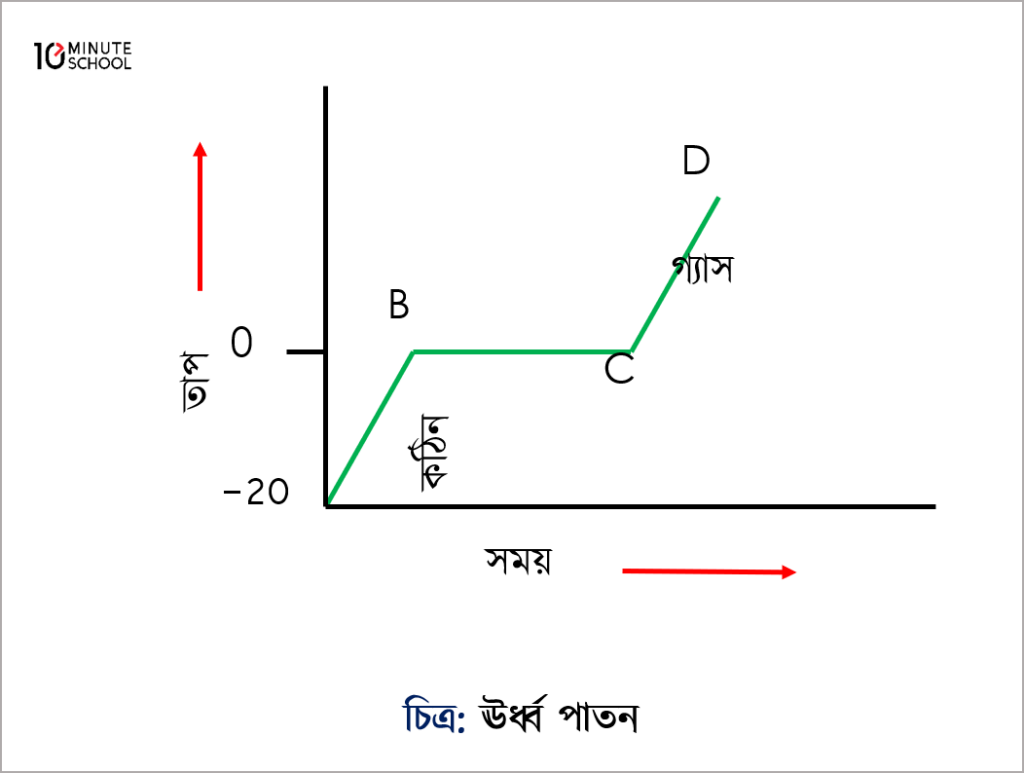
উর্ধ্বপাতিত পদার্থ আয়োডিনের লেখচিত্র (Graph of Sublimated Matter Iodine)
আয়োডিন একটি উদ্বায়ী পদার্থ। তাই এর কোনো তরল অবস্থা নেই। কঠিন আয়োডিনকে উত্তপ্ত করলে এটি সরাসরি বাষ্পে পরিণত হয়। কঠিন আয়োডিনকে তাপ দিলে প্রথমে এটি গরম হতে থাকে এবং নির্দিষ্ট তাপমাত্রায় পৌঁছার পর সরাসরি বাষ্পে পরিণত হতে থাকবে। এ সময় তাপমাত্রার কোনো পরিবর্তন হবেনা। কারণ প্রয়োগকৃত তাপ আয়োডিনকে কঠিন থেকে বাষ্পে যেতে ব্যবহার করছে। এখানে B – C রেখাটি সোজা। কারণ উক্ত রেখা দ্বারা আয়োডিনের উর্ধ্বপাতন বোঝানো হয়েছে।