নন-রেডক্স বিক্রিয়া (Non Redox Reaction) ও বিশেষ ধরনের রাসায়নিক বিক্রিয়া
এমন অনেক বিক্রিয়া আছে যেখানে ইলেকট্রনের আদান-প্রদান ঘটে না। এসব বিক্রিয়াকে আলাদা আলাদা শ্রেণিতে রাখা হয়েছে।
এক বা একাধিক বিক্রিয়ক থেকে নতুন যৌগ উৎপন্ন করার সময় বিক্রিয়কে বিদ্যমান মৌলসমূহের মধ্যে ইলেকট্রনের আদান-প্রদান না হলে ঐ বিক্রিয়াকে নন-রেডক্স বিক্রিয়া বলে।
এই পর্যায়ে তোমরা প্রশমন ও অধ:ক্ষেপণ বিক্রিয়া সম্পর্কে জানবে।
১. প্রশমন বিক্রিয়া (Nutralization Reaction):
যে বিক্রিয়ায় জলীয় দ্রবণে এসিড ও ক্ষার বিক্রিয়া করে পরস্পর প্রশমিত হয়ে লবণ ও পানি উৎপন্ন করে তাকে প্রশমন বিক্রিয়া বলে।
- এ ধরনের বিক্রিয়াকে এসিড-ক্ষার বিক্রিয়াও বলে।
\mathrm{HCl}(\mathrm{aq})+\mathrm{NaOH}(\mathrm{aq}) {\rightarrow} \mathrm{NaCl}(\mathrm{aq})+ \mathrm{H_2O}(\mathrm{l})
এক্ষেত্রে এসিড \mathrm{HCl} থেকে \mathrm{H^+} এবং ক্ষার \mathrm{NaOH} থেকে \mathrm{OH^-} পরস্পর বিক্রিয়া করে পানি উৎপন্ন করে। \mathrm{NaCl} জলীয় দ্রবণে \mathrm{Na^+} এবং \mathrm{Cl^-} আয়ন হিসেবে থাকে।
সুতরাং \mathrm{Na^+} ও \mathrm{Cl^-} দর্শক আয়ন।
\mathrm{Na^+}+\mathrm{OH^-}+\mathrm{H^+}+\mathrm{Cl^-} {\rightarrow} \mathrm{Na^+Cl^-}+ \mathrm{H_2O};\Delta H=-57.34\text{ kJ}
- প্রশমন বিক্রিয়ায় সর্বদাই তাপ উৎপন্ন হয়। তীব্র এসিড ও ক্ষার এর বিক্রিয়ায় \Delta H=-57.34\text{ kJ}! একে প্রশমন তাপ বলে। [ প্রশমন তাপ = 1mol পানি উৎপন্ন করতে প্রয়োজনীয় তাপ]
২. অধ:ক্ষেপণ বিক্রিয়া (Precipitation Reaction):
যে বিক্রিয়ায় তরল বিক্রিয়ক পদার্থ বিক্রিয়া করে কঠিন ও অদ্রবণীয় উৎপাদে পরিণত হয় তাকে অধ:ক্ষেপণ বিক্রিয়া বলে।
⇒ একই দ্রাবকে দুটি যৌগ মিশ্রিত করলে তারা পরস্পর বিক্রিয়া করে তাদের মধ্যে কোনোটি যদি ঐ দ্রাবকে অদ্রবণীয় বা খুবই কম দ্রবণীয় হয় তবে তা বিক্রিয়া পাত্রের তলায় কঠিন অবস্থায় তলানি হিসেবে জমা হয় যাকে অধ:ক্ষেপ বলে।
যেমন:
![]()
কিছু অদ্রবণীয় যৌগ:
\mathrm{BaSO_4, PbSO_4, AgCl, CaSO_4, BaCl_2, CuS, PbS, PbI_2, Fe(OH)_2, AgBr}
\Rightarrow \mathrm{Fe(OH)_2} এর অধঃক্ষেপের রং সবুজ।
\mathrm{KMnO_4}এর অধঃক্ষেপের রং বাদামি।
⇒ কিছু অধঃক্ষেপণ বিক্রিয়ায় ইলেকট্রনের স্থানান্তর ঘটে।
বিশেষ ধরনের রাসায়নিক বিক্রিয়া (Special types of Chemical Reaction)
কিছু কিছু বিক্রিয়া আছে যারা রেডক্স বা নন-রেডক্স শ্রেণিতে পড়ে না। এমন কিছু বিক্রিয়া সম্পর্কে জানব এখন।
৩. আর্দ্র বিশ্লেষণ/পানি বিশ্লেষণ (Hydrolysis) বিক্রিয়া:
কোনো যৌগের দুই অংশ পানির বিপরীত আধানবিশিষ্ট দুই অংশের সাথে যুক্ত হয়ে নতুন যৌগ যেই বিক্রিয়ায় উৎপন্ন করে তাকে আর্দ্রবিশ্লেষণ বিক্রিয়া বলে।
\mathrm{SiCl}_4+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Si}(\mathrm{OH})_4+4 \mathrm{HCl}
\mathrm{Al}(\mathrm{OH})_3(\mathrm{s})+3 \mathrm{HCl}(a q)
আর্দ্রবিশ্লেষণ বিক্রিয়ায় অনেক সময় অস্বচ্ছ দ্রবণীয় যৌগ উৎপন্ন হয়। এটি অল্প মাত্রায় দ্রবণীয় হওয়ায় যৌগটি অধঃক্ষেপিত হয়ে যায় যেমনটা হয়েছে ২য় বিক্রিয়ায়, এক্ষেত্রে \mathrm{Al}(\mathrm{OH})_3 অধঃক্ষেপ।
৪. পানিযোজন (Hydration) বিক্রিয়া :
আয়নিক যৌগ কেলাস গঠনের সময় নির্দিষ্ট সংখ্যক পানির অণুর সাথে যুক্ত হয়। এই পানির অণুকে কেলাস বলে এবং এই বিক্রিয়াকে পানিযোজন বিক্রিয়া বলে।
যেমন: \mathrm{CuSO_4} এর সাথে 5 অণু পানি যুক্ত হয়ে পেন্টা হাইড্রেট কপার (II) সালফেট উৎপন্ন করে।

⇒ পানিযোজন ও সংযোজন বিক্রিয়ার মধ্যে পার্থক্য হল সংযোজন বিক্রিয়ায় ইলেকট্রনের স্থানান্তর হয়, যা পানিযোজন বিক্রিয়ায় হয় না। এছাড়া বিক্রিয়া দুটি একই রকম।
৫. সমাণুকরণ (Isomerisation) বিক্রিয়া:
যে বিক্রিয়ায় অণুতে বিদ্যমান পরমাণুসমূহ পুনঃবিন্যস্ত হয়ে নতুন যৌগ গঠন করে তাকে সমাণুকরণ (Isomerisation) বিক্রিয়া বলে।
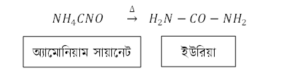
এখানে অ্যামোনিয়াম সায়ানেট ও ইউরিয়াতে একই মৌলের একই সংখ্যক পরমাণু আছে। এক্ষেত্রে তাদের বন্ধনে পরিবর্তন আসায় তাদের গঠন ভিন্ন এবং তারা ভিন্ন যৌগ হয়েছে।
⇒ যখন দুটি যৌগের আণবিক সংকেত একই থাকে কিন্তু গাঠনিক সংকেত ভিন্ন হয় তখন তাদেরকে পরস্পরের সমাণু বলে।
সুতরাং অ্যামোনিয়াম সায়ানেট ও ইউরিয়া পরস্পর সমাণু।
৬. পলিমারকরণ (Polymerization) বিক্রিয়া:
প্রভাবক, উচ্চ চাপ ও তাপের প্রভাবে যখন এক বা একাধিক যৌগের ক্ষুদ্র ক্ষুদ্র অণু পরস্পরের সাথে যুক্ত হয়ে একটি বৃহদাকার অণু গঠণ করে তখন তাকে পলিমারকরণ (Polymerization) বিক্রিয়া বলে।
⇒ বৃহদাকার অণুটিকে পলিমার এবং ক্ষুদ্রাকার অণুটিকে মনোমার বলে।
⇒ এই বিক্রিয়ায় অসংখ্য মনোমার থেকে পলিমার উৎপন্ন হয়। যেমন:
![]()
