P ব্লক মৌল (P Block Elements)
প্রশ্নঃ P ব্লক মৌলগুলোর ভৌত বৈশিষ্ট্য আলোচনা কর। (Physical Properties of P block Elements)
উত্তরঃ
- এদের মধ্যে ধাতু অধাতু এবং অপ বা উপধাতু বিভিন্ন প্রকার মৌলের সংমিশ্রণ আছে। P ব্লক মৌলের সংখ্যা ৩৬। এদের মধ্যে ধাতু ১২টি অপধাতু ৭টি ( B, Si, Ge, As, Sb, Te, At) অবশিষ্টগুলো অধাতু।
- এদের মধ্যে 15 নং গ্রুপের মৌলগুলোকে Pnictogen বা নিকটোজেন বা শ্বাসরোধকারা গ্রুপ বলে। 16 নং গ্রুপের মৌলগুলোকে চ্যালকোজেন বা আকরিক উৎপন্নকারী মৌল, 17 নং গ্রুপের মৌলগুলোকে হ্যালোজেন বা সামুদ্রিক লবণ উৎপন্নকারী মৌল, 18 নং গ্রুপের মৌলকে নিষ্ক্রিয় গ্যাস বলা হয়।
- এদের রাসায়নিক ধর্ম মূলত P ইলেক্ট্রন এর উপর নির্ভরশীল । যেমন ns2np1 বিন্যাস যুক্ত মৌলগুলো সহজেই আয়নিক বন্ধন গঠন করতে পারে আবার ns2 np5 বিন্যাস যুক্ত মৌলগুলো আয়নিক ও সমযোজী উভয় প্রকার বন্ধন গঠন করতে পারে।
- এদের মধ্যে অনেক মৌল পরিবর্তনশীল যোজনী দেখায়। যেমন- ফসফরাস (3, 5), সালফার (2, 4, 6)
- এদের মধ্যে অনেক মৌল অবস্থা ভেদে একই মৌলের সাথে বিভিন্ন ধরনের যৌগ গঠন করতে পারে। যেমন – SO₂, SO3
- এদের অধিকাংশ মৌল অধাতু তাই এরা e− গ্রহণ করে ঋণাত্মক আয়ন এ পরিণত হতে পারে অর্থাৎ এরা জারক হিসেবে কাজ করে।
- এদের তড়িৎ ঋণাত্মকতা বেশি।
- এদের দ্বারা গঠিত যৌগের গলনাংক, স্কুটনাংক, দ্রাব্যতা, তড়িৎ পরিবাহীতা মূলত বন্ধন প্রকৃতির উপর নির্ভরশীল।
- P ব্লক মৌলসমূহের নিজস্ব গলনাংক, স্ফুটনাংক এর মান মৌলের ধাতব প্রকৃতির, অধাতব প্রকৃতি এবং পরমাণুকত্ব এর উপর নির্ভর করে।
গ্রুপ IIIA বা 13 নং এর মৌলগুলোর বৈশিষ্ট্যর সমূহ লিখ।(Properties of group 13 Elements)
এই গ্রুপের মৌলগুলো হলোঃ
| B (5)
Al (13) Ga (31) In (49) Tl (81) Nh (113) |
ns2 np1 এদের মধ্যে উপর থেকে নিচে গেলে ধাতব ধর্ম বৃদ্ধি পায়। |
ধর্ম – ১: যৌগের বন্ধন প্রকৃতিঃ
- এদের সর্ববহিঃস্থরে ৩টি e− থাকায় সহজে আয়নিক বন্ধন গঠন করে। তবে B সমযোজী বন্ধন গঠন করে।
2) Oxide এর প্রকৃতি:
Boron উচ্চতর তাপমাত্রায় O2 দ্বারা জারিত হয়ে B2O3 (Boron Tri Oxide) গঠন করে যা একটি অম্লধর্মী Oxide. Al বায়ুর O2 এর সাথে কিছুটা দ্রুত বিক্রিয়া করে Al2O3 গঠন করে যা উভধর্মী Oxide।
এর পরবর্তী মৌলসমূহ Oxide গঠন করে যারা ক্ষারধর্ম দেখায়।
- B2O3 + 2NaOH 2NaBO2 + H2O
Na-মেটাবোরেট
- Al2O3 + 6HCl 2AlCl3 + 3H2O
অম্ল
Al2O3 + 2NaOH 2NaAlO2 + H2
ক্ষার
- M2O3 + 6HCl 2MCl3 + 3H2O [M = Ga, In, Tl]
উল্লেখ্য যে, Al ধাতু বায়ুর O2 এর সাথে বিক্রিয়া করে এর পৃষ্ঠতলে একটি নিষ্ক্রিয় Oxide স্তর (Al2O3) তৈরি করে একারণে Al ধাতু সহজে ক্ষয়প্রাপ্ত হয় না এবং বহুল ব্যবহৃত হয়।
- কার্বন এবং N এর সাথে বিক্রিয়া:
এরা C ও N এর সাথে বিক্রিয়া করে কার্বাইড ও নাইট্রাইড গঠন করে। যারা পুনরায় আর্দ্র বিশ্লেষিত হয়ে বিভিন্ন ধরণের উৎপাদে পরিণত হয়।
9000C
2Al + N2 2AIN; 2B + N2 2BN (অজৈব গ্রাফাইট বলে)
AIN + H2O Al2(OH)3 + NH3
- এসিড এর সাথে বিক্রিয়াঃ
বোরন ছাড়া বাকী মৌলগুলো HCl এর সাথে বিক্রিয়া করে H2 গ্যাস উৎপন্ন করে।
2Al + 6HCl → 2AlCl3 + 3H2
তবে জারণ ধর্মী Acid যেমন গাঢ় HNO3 ও গাঢ় H2SO4 এর সাথে সাথে নিন্মরূপে বিক্রিয়া করে।
2Al + 6H2SO4 Al2(SO4)3 + 3SO2 + 6H2O
2Al + 12HNO3 2Al(NO3)3 + 6NO2 + 6H2O
তবে Boron উক্ত ২টি এসিডের সাথে নিম্নরূপ বিক্রিয়া করে Boric Acid এ পরিণত হয়।
B + HNO3 H3BO3 + NO2
B + H2SO4 H3BO3 + SO2
Boric Acid
- হ্যালোজেন এর সাথে বিক্রিয়া করে এরা হ্যালাইড উৎপন্ন করে। যেমন AlCl3, BCl3 এ সমস্ত হ্যালাইড লুইস এসিড হিসেবে ব্যবহৃত হয়। এরা সমযোজী বৈশিষ্ট্যর দেখায়।
নিম্ন তাপমাত্রায় AlCl3 ডাইমার বা Al2Cl6 গঠন করে ব্যাখ্যা করো?(Physical Structure of Al2Cl6)
AlCl3 এ A3+ এর চার্জ ঘনত্ব বেশি হওয়ার কারণে এর পোলারায়ন ক্ষমতা বেশি ফলে যৌগটির মধ্যে সমযোজী বৈশিষ্ট্য প্রকাশ পায়। পোলারাইজেশনের কারণে ইলেকট্রন ঘনত্ব দুই নিউক্লিয়াসের মধ্যবর্তী স্থানে স্থানান্তরিত হওয়ায় Al এর চারদিকে অষ্টক অপূর্ণ থাকে বলে এ অভাব পূরণের জন্য পাশাপাশি দুটি AlCl3 নিজেদের মধ্যে সন্নিবেশ বন্ধন গঠনের মাধ্যমে ডাইমার গঠন করে বা Al2Cl6 গঠন করে। এক্ষেত্রে একটি AlCl3 এর Cl পরমাণু নি:সঙ্গ ইলেকট্রন জোড়ের মাধ্যমে অপর AlCl3 এর Al এর সাথে সন্নিবেশ বন্ধন গঠন করে।
উল্লেখ্য যে, বোরন পরমাণুর আকার ছোট হওয়ায় এর চারিদিকে চারটি CI পরমাণু অবস্থান করতে পারে না তাই BCl3 ডাইমার গঠন করে না।
গ্রুপ 14 বা IVA গ্রুপের মৌলগুলোর রাসায়নিক ধর্ম আলোচনা করে দেখাওঃ(Chemical Properties of Group 14 elements)
এই গ্রুপের মৌলগুলো নিমরূপঃ
C (6)
Si (14)
Ge (32) বহিস্তর বিন্যাস ns2np2
Sn (50)
Pb (82)
FI(114)
এদের মধ্যে C ও Si অধাতু; Ge অর্ধধাতু, এবং Sn, Pb, FI ধাতু। এদের বৈশিষ্ট্য নিম্নরূপ:
- H2 এর সাথে বিক্রিয়াঃ
এই গ্রুপের সব মৌলই H এর সাথে হাইড্রাইড তথা টেট্রা হাইড্রাইড গঠন করে।
CH4 → মিথেন
SiH4 → সিলেন
GeH4 → জারমেন
SnH4 → স্ট্যানেন
PbH4 → প্লাম্বেন
তবে উচ্চ পারমাণবিক ভরের হাইড্রাইডগুলো অস্থায়ী।
- ক্লোরাইড গঠন:
এদের মধ্যে সব মৌলই টেট্রা ক্লোরাইড যৌগ গঠন করে যেমন CCl4; SiCl4 তবে Sn ও Pb ডাই ক্লোরাইড যৌগ গঠন করতে পারে। যেমন SnCl2; PbCl2
- ক্ষারের সাথে বিক্রিয়া
এই গ্রুপের মৌলগুলো ক্ষারের সাথে বিক্রিয়া করে লবণ ও H2 গ্যাস উৎপন্ন করে। যেমন-
Si + 2NaOH + H2O → Na2SiO3 + H2
- এদের মধ্যে Si, C ও Ge এর সুস্থিত যোজ্যতা 4 কিন্তু Si এর ক্ষেত্রে অষ্টক সম্প্রসারণ সম্ভব হয়।
তাছাড়া Sn ও Pb এর যোজনী 2 হতে পারে।
- ক্লোরাইড এর আর্দ্র বিশ্লেষণ বিক্রিয়ার প্রকৃতিঃ
এই গ্রুপের মৌলগুলো মধ্যে CCl4 ছাড়া বাকী ক্লোরাইড যেমন SiCl4 আর্দ্র বিশ্লেষিত হতে পারে।
প্রশ্নঃ CCl4 আর্দ্র বিশ্লেষিত হয়না কিন্তু SiCl4 হয় কেন?(Hydrolysis of SiCl4 and CCl4)
উত্তর: সাধারণ কোনো সমযোজী যৌগের আর্দ্র বিশ্লেষণ বিক্রিয়ার কৌশল হচ্ছে পানির অনু এর O2 পরমাণুর (O) নিঃসঙ্গ e– যুগল এর মাধ্যমে ঐ যৌগের কেন্দ্রিয় পরমাণুর সাথে একটি সন্নিবেশ বন্ধন সৃষ্টি করে অস্থায়ী যৌগ গঠন করে। যা পরে বিযোজিত হয়ে স্থায়ী যৌগে পরিণত হয়।
সাধারণত যে সমস্ত পরমাণুর অষ্টক সম্প্রসারণ সম্ভব হয় তথা যোজ্যতাস্তরে খালি d অরবিটাল থাকে বা অস্টক অপূর্ণ থাকায় যোজ্যতাস্তরে ইলেকট্রন ধারণ ক্ষমতা আছে। তারাই এ ধরণের অস্থায়ী যৌগ গঠন করে। যেহেতু Si তৃতীয় পর্যায় এর মৌল তাই এর যোজ্যতা স্তরে খালি 3d Orbital আছে, যেখানে, H2O কর্তৃক প্রদত্ত e– জোড় গ্রহণ করা সম্ভব। অর্থাৎ Si এর অষ্টক সম্প্রসারণ সম্ভব। কিন্তু C ২য় পর্যায় এর মৌল হওয়ায় এর যোজ্যতা স্তরে 2d Orbital নেই তাই এটি পানি কর্তৃক প্রদত্ত e– জোড় গ্রহণ করতে পারে না ফলে CCl4 আর্দ্র বিশ্লেষিত হয় না।
কৌশল:-
SiCl4 + 4H2O → Si(OH)4 + 4HCl
CCl4 + H20 → বিক্রিয়া হয় না
Si* ………3s13px13py13pz1
C* ………2s12px12py12pz1
- ক্যাটেনেশান ধর্মঃ
কার্বন পরমাণুর আকার ছোট ও যোজনী 4 হওয়ার কারণে অসংখ্য C পরমাণু পরস্পরের সাথে যুক্ত হয়ে দীর্ঘ শিকল তৈরি করে। কিন্তু Si পরমাণুর আকার বড় হওয়ার কারণে পাশাপাশি Si এর মধ্যে বিকর্ষণ হয় অর্থাৎ Si ক্যাটেনেশান ধর্ম দেখা যায় না।
- পানির সাথে বিক্রিয়াঃ
এই গ্রুপের মৌলগুলো লোহিত তপ্ত অবস্থায় Steam এর সাথে বিক্রিয়া করে।
C (লোহিত তপ্ত) + H2O(g) 100 c CO + H2
Si(g) + 2H2O(g) → SiO2 + 2H2
কিন্তু Pb কক্ষ তাপমাত্রায় মৃদু পানির সাথে খুব ধীরে বিক্রিয়া করে Pb(OH)2 ও H2 গ্যাস উৎপন্ন করে। উৎপন্ন Pb(OH)2; H2O তে দ্রবীভূত হয়ে দূষিত করে।
Pb + 2H20 → Pb(OH)2 + H2
এ দূষিত পানি পান করলে শরীরে বিষক্রিয়া ঘটে দাতের মাড়ি নীলাভ হয় একে লেড এর বিষক্রিয়া বলে।
- জারণ অবস্থাঃ
গ্রুপ- IVA মৌলের যোজনী স্তরে চারটি ইলেকট্রন ns2 np2 থাকার তাদের পক্ষে চার যোজনীবিশিষ্ট আয়নিক যৌগ গঠন করা অসম্ভব। কেননা, চারটি ইলেকট্রন গ্রহণের মাধ্যমে M4- আয়ন গঠনে ইলেকট্রন আসক্তি বা চারটি ইলেকট্রন বর্জনের মাধ্যমে M4+ আয়নীকরণ শক্তির পরিমাণের দিকে থেকে খুবই কঠিন। ফলে এসব যৌগ সাধারণত চার যোজনী বিশিষ্ট সমযোজী যৌগ গঠন করে। তাই গ্রুপ- IVA মৌলসমূহের সাধারণ জারণ সংখ্যা +4। অপরদিকে ভারী তিনটি মৌল (যেমন, Ge, Sn, Pb) শুধুমাত্র p অরবিটাল থেকে দুটি ইলেকট্রন ত্যাগের মাধ্যমে M2+ আয়ন গঠন করতে পারে। যেখানে ns2 ইলেকট্রন দুটি নিষ্ক্রিয় জোড় হিসেবে অবশিষ্ট থাকে। এ ইলেকট্রনের স্থিতিশীলতা উপর থেকে নীচের দিকে বাড়ে। এক্ষেত্রে তাদেরও জারন অবস্থা +2 হয়।
তাদের np2 ইলেকট্রন অপসারণঃ Sn Sn2+ + 2e–
Pb Pb2+ + 2e–
তাদের ns2np2 ইলেকট্রন অপসারণঃ Sn Sn4+ + 4e–
তবে কার্বন ও সিলিকনের বেলায় তাদের স্থিতিশীল জারণ সংখ্যা হল +4। লেডের স্থিতিশীল জারন অবস্থা হল +2 অর্থাৎ Pb2+ স্থিতিশীল; Pb4+ আয়ন অস্থিতিশীল, তাই Pb ইলেকট্রন গ্রহণ করে বলে জারক।
Ge2+ < Sn2+ < Pb2+
সুতরাং স্থিতিশীলতা বৃদ্ধি পায়
Ge4+ > Sn4+ > Pb4+
আবার স্থিতিশীলতা বৃদ্ধি পায়
- বহুরূপতাঃ
গ্রুপ -IVA মৌলগুলোর বহুরূপতা ধর্ম আছে। কার্বনের দানাদার রূপভেদ হল গ্রাফাইট ও ডায়মন্ড, অদানাদার রূপভেদ হল কোক কার্বন, চারকোল, কয়লা ও কার্বন ব্ল্যাক্। সিলিকনের দানাদার ও অদানাদার দুটি রূপভেদ আছে জার্মেনিয়ামের দু’রকম দানাদার রূপভেদ আছে। টিন ধাতুর তিনটি রূপভেদ যেমন ধূসর টিন, সাদা টিন ও রম্বিক টিন আছে।
CO2 একটি গ্যাস কিন্তু SiO2 কঠিন পদার্থ কেন? (Why is CO2 gaseous but SiO2 solid?)
কার্বন ও অক্সিজেন পরমাণুর আকার প্রায় সমান হওয়ায় C এবং O পরমাণুর যোজ্যতাস্তরের অরবিটাল অধিক্রমণের মাধ্যমে প্রথমে সিগমাবন্ধন গঠনের পর অরবিটালসমূহের পাশ্বঅধিক্রমনের মাধ্যমে পাই বন্ধন গঠিত হয়ে পরস্পরের মধ্যে দ্বিবন্ধন গঠন করে (O = C = O),অথাৎ কার্বন ডাইক্সাইড একক বন্ধন রুপে অবস্থান করে। অণুগুলো অপোলার হওয়ার এদের মধ্যে পারস্পরিক আকর্ষণ বলও খুব কম।তাই সাধারণ তাপমাত্রায় কার্বন ডাইঅক্সাইড গ্যাসীয় পদার্থ। এদের মধ্যে দুর্বল ভ্যানডার ওয়ালস আকর্ষণ বল ক্রিয়াশীল। অন্যদিকে, Si পরমাণুর O চেয়ে আকরে বড় হওয়ায় অরবিটাল অধিক্রমণের মাধ্যমে প্রথমে সিগমা বন্ধন গঠন করার পর পরমাণুগুলো পরস্পর থেকে দূরে থাকায় এদের মধ্যে পার্শ্ব অধিক্রমন সম্ভব নয় তথা পাই বন্ধন গঠিত হয় না। তাই এদের মধ্যে দ্বিবন্ধন গঠিত হয় না, ফলে O = Si = O গঠনাকৃতিবিশিষ্ট অণু গঠিত হয় না। অর্থাৎ, সিলিকন ডাইঅক্সাইড (SiO2) একক অনুরূপে থাকে না। পরিবর্তে প্রতিটি sp3 সংকরায়িত Si পরমাণু ৪টি O পরমাণুর সাথে এবং প্রতিটি sp3 সংকরিত O পরমাণুর ২টি Si পরমাণুর সাথে সমযোজী একক বন্ধন দ্বারা চতুস্তলকীয়ভাবে যুক্ত হয়ে সিলিকন ডাইঅক্সাইডের একটি বিরাট বা দৈত্যকার অণু [(SiO2)n] গঠন করে। এই জাতীয় গঠনের জন্যই সিলিকন ডাইঅক্সাইড সাধারণ তাপমাত্রায় কঠিন পদার্থ ।
অক্সাইডের প্রকৃতিঃ (Properties of Oxides)
গ্রুপ-IVA এর ১ম মৌল কার্বন নিশ্চিতভাবে একটি অধাতু। তাই কার্বনের অক্সাইড অম্লধর্মী বা নিরপেক্ষ হবে।কার্বন মনোক্সাইড CO নিরপেক্ষ। অপরদিকে কার্বনের স্বাভাবিক অক্সাইড CO2 অম্লধর্মী। প্রমাণস্বরূপ বলা যায়, তা ক্ষারকের সাথে যেমন NaOH এর সাথে বিক্রিয়া করে কার্বনেট লবণ ও পানি উৎপন্ন করে।
CO2 + 2NaOH → Na2CO3 + H2O [CO2 এর অম্লধর্মের প্রমাণ]
গ্রুপ-IVA এর ২য় মৌল সিলিকন একটি অধাতু। সুতরাং সিলিকনের অক্সাইড অম্লধর্মী। তাই SiO2 ক্ষারকের সাথে যেমন NaOH এর সাথে বিক্রিয়া করে সোডিয়াম সিলিকেট ও পানি উৎপন্ন করে । SiO2 এসিডের সাথে বিক্রিয়া করে না।
SiO2 + 2NaOH → Na2SiO3 + H2O [SiO2 এর অম্লধর্মের প্রমাণ]
গ্রুপ-IV এর ৩য় মৌল জার্মেনিয়াম একটি অর্ধধাতু। এতে ধাতু ও অধাতুর কিছু বৈশিষ্ট্য বিদ্যমান। এর স্বাভাবিক অক্সাইড GeO2 অম্ন ও ক্ষারক উভয় ধর্ম দেখায়। যেমন এটি গাঢ় H2SO4 এসিড বা HCl এসিডের সাথে বিক্রিয়া করে জার্মেনিয়াম লবণ উৎপন্ন করে।আবার ক্ষারের সাথে বিক্রিয়া করে জার্মেনেট লবণ উৎপন্ন করে।
GeO2 + 4HCI → GeCl4 + 2H2O
GeO2 + 2H2SO4 → Ge(SO4)2 + 2H2O [এর ক্ষারক ধর্মের প্রমাণ]
GeO2 + 4NaOH → Na4GeO4 + H2O [GeO2 এর অম্ল ধর্মের প্রমাণ]
সোডিয়াম জার্মেনেট
তবে জার্মেনিয়াম লবণসমূহ অস্থিতিশীল এবং সহজেই পানি দ্বারা আর্দ্র বিশ্লেষিত হয়। এক্ষেত্রে বোঝা যায় যে, GeO2 এর ক্ষারকধর্ম খুব দুর্বল।
গ্রুপ-IVA এর ৪র্থ মৌল টিনের দুটি বৈশিষ্ট্যমূলক অক্সাইড SnO ও SnO2 আছে। তাদের মধ্যে টিনের জারণ সংখ্যা যথাক্রমে +2 ও +4। উভয় অক্সাইড উভধর্মী। তবে SnO তে Sn- এর জারণ সংখ্যা কম হওয়ায় তা অধিকতর ক্ষারকধর্মী এবং SnO2 তে Sn এর জারণ সংখ্যা +4 হওয়ায় তা অধিকতর অম্লধর্মী। নিম্নলিখিত বিক্রিয়াসমূহ থেকে তাদের উভধর্মিতার প্রমাণ মেলে। স্ট্যানাস অক্সাইড (SnO) এসিডের সাথে স্ট্যানাস ক্লোরাইড (SnCl) ও ক্ষারকের সাথে স্ট্যানাইট লবণ উৎপন্ন করে। অপরদিকে স্ট্যানিক অক্সাইড (SnO2) এসিডের সাথে যেমন HCl এর সাথে স্ট্যানিক লবণ ও ক্ষারকের সাথে যেমন NaOH এর সাথে বিক্রিয়া করে সোডিয়াম স্ট্যানেট লবণ ও পানি উৎপন্ন করে।
SnO + 2HCl → SnCl2 + H2O [SnO এর ক্ষারক ধর্মের প্রমাণ]
SnO + 2NaOH → Na2SnO2 + H2O [SnO এর অম্ল ধর্মের প্রমাণ]
SnO2 + 4HCl → SnCl4 + 2H2O [SnO2এর ক্ষারক ধর্মের প্রমাণ]
SnO2 + 2NaOH → Na2SnO3 + H2O [SnO2 এর অম্লধর্মের প্রমাণ]
গ্রুপ -IVA এর ৫ম মৌল লেড এর দুটি বৈশিষ্ট্যমূলক অক্সাইড PbO ও PbO2 আছে। তাদের মধ্যে লেড-এর জারণ সংখ্যা যথাক্রমে -2 ও +4। উভয় অক্সাইড উভধর্মী। যেমন তারা উভয়েই ক্ষার ও অম্লের সাথে পৃথকভাবে বিক্রিয়া করে প্রতি ক্ষেত্রে লবণ ও পানি উৎপন্ন করে।
PbO + 2HNO3 → Pb(NO3)2 +H2O [PbO এর ক্ষারক ধর্মের প্রমাণ]
PbO + 2NaOH → NaPbO2 + H2O [PbO এর অম্ল ধর্মের প্রমাণ]
সোডিয়াম প্লাম্বাইট
PbO2 + 4HCI → PbCl4+ 2H2O [PbO2 এর ক্ষারক ধর্মের প্রমাণ]
PbO2 + 2NaOH → Na2PbO3 + H2O [Pb02 এর অম্ল ধর্মের প্রমাণ]
Na-প্লাম্বেট
15 নং গ্রুপের মৌলগুলোর রাসায়নিক ধর্মগুলো বিশ্লেষণ কর।(Chemical properties of group 15 elements)
এই গ্রুপের মৌলগুলো হলোঃ N (Nitrogen), P (Phosphorus), As (Arsenic), 51Sb (Antimony), 83Bi (Bismuth), 115Mc (Moscovium). এদেরকে নিকটোজেন (Pnictogen) বা শ্বাসরোধকারী মৌল বলে।
এদের রাসায়নিক ধর্মগুলো হল-
এই গ্রুপের মৌলগুলো ধাতুর সাথে বিক্রিয়া করে নাইট্রাইড এবং ফসফাইড যৌগ গঠন করে। যেমন- Mg3N2 এবং AlP ইত্যাদি। এ গ্রুপের মৌলসমূহের মধ্যে নাইট্রোজেন দ্বিপরমাণুক হওয়া সত্ত্বেও এদের মধ্যে ত্রিবন্ধন থাকায় এটি স্বাভাবিক অবস্থায় নিষ্ক্রিয়। নাইট্রোজেনের অপর নাম অ্যাজোট বা নিষ্ক্রিয়। প্রকৃতপক্ষে নিষ্ক্রিয় গ্যাসসমূহের পরে নিষ্ক্রিয় হিসেবে নাইট্রোজেন গ্যাসকে বিবেচনা করা হয়। তাই বিভিন্ন বিক্রিয়ার মাধ্যমে নাইট্রোজেন গ্যাস নিষ্ক্রিয় মাধ্যম হিসেবে ব্যবহৃত হয়। নাইট্রোজেনের ত্রিবন্ধন ভেঙ্গে নাইট্রোজেন পরমাণু তৈরি করতে প্রচুর শক্তি (947 Kjmol-1) প্রয়োজন হয়। নাইট্রোজেন প্রায় 3000°C তাপমাত্রায় অক্সিজেনের সাথে বিক্রিয়া করে নাইট্রোজেনের অক্সাইড তৈরি করে। অপরদিকে, চার পরমাণুক ফসফরাস বা P4 বিকৃত চতুস্তলকীয় আকারে অবস্থান করে। এর বন্ধন কোণের মান হ্রাস পাওয়ায় বেশী পীড়ন বা চাপের কারণে অস্থিতিশীল হয় অর্থাৎ অধিক সক্রিয় হয় তাই কক্ষ তাপমাত্রায় ফসফরাস অক্সিজেনের সাথে বিক্রিয়া করে ফসফরাসের অক্সাইড উৎপন্ন করে । P4 এর বন্ধন ভেঙ্গে P পরমাণু পরিণত করতে 209 Kjmol-1 শক্তি প্রয়োজন হয়। তবে ফসফরাসের দুটি রূপভেদের মধ্যে লোহিত (লাল) ফসফরাস (Pn) অপেক্ষা শ্বেত ফসফরাস (P4) অধিক সক্রিয়। তাই অনেক সময় এটিকে কেরোসিনের নিচে রাখা হয়।
এরা হাইড্রোজেনের সাথে বিক্রিয়া করে এ সমস্ত হাইড্রাইডগুলো ক্ষার ধর্ম দেখায়। যেমন-
: NH3 – অ্যামোনিয়া
: PH3 – ফসফিন
: AsH3 – আর্সেনিক ট্রাই হাইড্রাইড/ আর্সাইন ক্ষারধর্ম হ্রাস পায়
: SbH3 – স্ট্যাবাইন
: BiH3 – বিসাইন
লুইস মতবাদ অনুযায়ী, যে সমস্ত যৌগের ইলেক্ট্রন জোড় দান করার ক্ষমতা আছে তাদেরকে লুইস ক্ষারক বলে। আবার প্রোটনীয় ধারণামতে যেসমস্ত যৌগ গ্রহণ করে তাদেরকেও ক্ষারক বলে। যে যৌগের ইলেকট্রন দানের প্রবণতা বেশী বা গ্রহণের প্রবণতা বেশী তারা শক্তিশালী ক্ষারক হয়। এ সমস্ত হাইড্রাইডসমূহের মধ্যে কেন্দ্রীয় পরমাণুতে নিঃসঙ্গ ইলেক্ট্রন জোড় থাকায় এরা ক্ষারধর্ম দেখায়। তবে পরমাণুর আকার হ্রাস পেলে এবং তড়িৎ ঋণাত্মকতা বৃদ্ধি পেলে ঐ পরমাণুর চারিদিকে ইলেক্ট্রন ঘনত্বের পরিমাণ বৃদ্ধি পায় তথা ইলেক্ট্রন জোড় শেয়ারে দানের ক্ষমতাও বৃদ্ধি পায়। ফলে শক্তিশালী ক্ষারক হয়। এ কারণে এদের মধ্যে শক্তিশালী ক্ষারক।
- 〖??〗_? এবং 〖??〗_? এর মধ্যে কোনটি অধিক ক্ষারধর্মী এবং কেন? (Basicity of NH3 and PH3)
পরমাণুর আকার ছোট এবং তড়িৎ ঋণাত্মকতা বেশি হলে অধিক ক্ষারধর্মী হয়। N এর তড়িৎ ঋণাত্মকতা বেশী এবং আকার ছোট হওয়ায় কারণে P – H বন্ধনের তুলনায় N – H বন্ধনের ইলেকট্রন মেঘের ঘনত্ব N পরমাণুর দিকে অধিক আকৃষ্ট হয়। এর ফলে পরমাণুর চারিদিকে ইলেকট্রন ঘনত্ব বেশী হওয়ায় এর পক্ষে ইলেকট্রন জোড় শেয়ারে দান করা সহজ হয় বলে অধিক ক্ষারধর্মী।
৪। এরা অক্সিজেনের সাথে বিক্রিয়া করে বিভিন্ন ধরনের অক্সাইড গঠন করে। যেমন- নাইট্রোজেনের 5টি অক্সাইডের মধ্যে নিরপেক্ষ। ইত্যাদি অম্লধর্মী। তবে ফসফরাসের দুটি স্থায়ী অক্সাইড ও উভয়ই অম্লধর্মী।
৫। এরা হ্যালোজেনের সাথে বিক্রিয়া করে ট্রাই-হ্যালাইড ও পেন্টা-হ্যালাইড গঠন করতে পারে। তবে ছাড়া অবশিষ্ট হ্যালাইডগুলো আর্দ্র বিশ্লেষিত হতে পারে। এ গ্রুপের মৌলগুলোর সমযোজ্যতা ৩ ও ৫। উল্লেখ্য যে, নাইট্রোজেনের যোজ্যতা স্তরে d অরবিটাল না থাকার কারণে এটি সমযোজ্যতা (সমযোজী যোজনী) 5 দেখায় না। শুধু ৩ দেখায়।
একই গ্রুপে অবস্থান করা সত্ত্বেও ফসফরাসের সমযোজ্যতা 5 হলেও নাইট্রোজেনের সমযোজ্যতা 5 নয় কেন?
অথবা, এবং এর মধ্যে কোনটি সম্ভব তা কারণসহ উল্লেখ কর।(Existance of PCl5 and NCl5)
সাধারণত কোনো পরমাণুর যোজ্যতা স্তরে যতটি অযুগ্ন ইলেকট্রন থাকে এরা যুগ্ম হওয়ার জন্য আর যতটি ইলেকট্রন প্রয়োজন ঐ মৌলের সমযোজ্যতা তত হবে। উপরোক্ত ইলেকট্রন বিন্যাস হতে দেখা যায় যে, ফসফরাসের সমযোজ্যতা যথাক্রমে 3 এবং 5 হবে। অর্থাৎ এবং গঠিত হতে পারে।
এ বিন্যাস হতে দেখা যায়, নাইট্রোজেনের সমযোজ্যতা ৩ হবে। যেহেতু এর যোজ্যতাস্তরে d অরবিটাল নেই তাই এটি উদ্দীপিত করা যায় না। তথা আর অযুগ্ম ইলেকট্রনযুক্ত অরবিটাল তৈরী করা যায় না। তাই সম্ভব হলেও সম্ভব নয়।
- সম্ভব না হলেও সম্ভব কেন? (Why doesn’t N2O5 exist?)
এর গাঠনিক সংকেত নিম্নরূপ :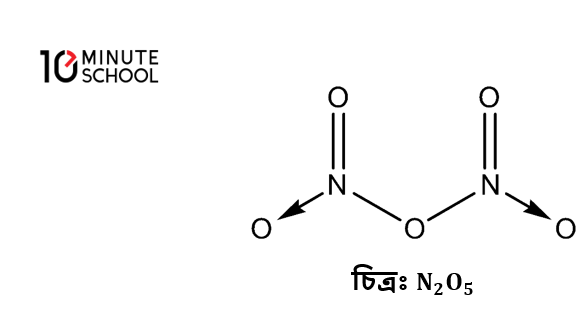
চিত্রঃ
এ গঠন হতে দেখা যায় যে, প্রতিটি নাইট্রোজেন পরমাণু দুটি অক্সিজেন পরমাণুর সাথে মোট তিনটি সমযোজী বন্ধন গঠন করার পর এদের যোজ্যতা স্তরে যে ইলেক্ট্রন জোড় থাকে তা আরেকটি অক্সিজেন পরমাণুকে দান করার মাধ্যমে সন্নিবেশ বন্ধন গঠন করে। এক্ষেত্রে নাইট্রোজেনের সমযোজ্যতা 3 এবং সন্নিবেশ যোজ্যতা 2 মিলে সর্বমোট যোজনী 5 হয়। তাই গঠিত হতে পারে ।
আর্দ্রবিশ্লেষিত না হলেও আর্দ্রবিশ্লেষিত হয় কেন? (Hydrolysis of NF3 vs NCl3)
(হাইপোক্লোরাস এসিড)
বিক্রিয়াটির কৌশল নিম্নরূপঃ
সাধারণত কোনো সমযোজী যৌগের আর্দ্র বিশ্লেষণের নিয়ম হলো এর কেন্দ্রীয় বা অন্য কোন পরমাণুর অষ্টক সম্প্রসারণ সম্ভব হলে বা খালি অরবিটাল থাকলে এরা পানির অক্সিজেন পরমাণু হতে ইলেকট্রন জোড় গ্রহণ করে একটি অস্থায়ী যৌগ গঠন করে বা শেষে বিযোজিত হয়ে স্থায়ী যৌগে পরিণত হয় । যৌগটিতে পরমাণুতে অরবিটাল না থাকলে ও ক্লোরিন পরমাণুর মধ্যে খালি অরবিটাল থাকার কারণে এটি পানি কর্তৃক প্রদত্ত ইলেকট্রন জোড় গ্রহণ করে একটি ক্ষণস্থায়ী মধ্যক তৈরি করে। যা বিযোজিত হয়ে স্থায়ী উৎপাদে পরিণত হয়। কিন্তু যৌগটিতে নাইট্রোজেন ও ফ্লোরিন কোনোটিতে অরবিটাল না থাকায় এটি পানি কর্তৃক প্রদত্ত ইলেকট্রন জোড় গ্রহণ করতে পারে না তাই আর্দ্র বিশ্লেষিত হয় না ।
অপেক্ষা দ্রুত আর্দ্রবিশ্লেষিত হয় কেন? (Speed of hydrolysis: NCl3 vs PCl3)
অথবা,
এক্ষেত্রে কেন্দ্রীয় পরমাণু ফসফরাসের যোজ্যতা স্তরে 3d অরবিটাল থাকার কারণে পানির অক্সিজেন পরমাণু ফসফরাসকে ইলেকট্রন জোড় দান করে। এভাবে একটি ক্ষণস্থায়ী যৌগ তৈরি হয় যা পরবর্তীতে বিযোজিত হয়ে স্থায়ী উৎপাদে পরিণত হয়।
সমযোজী যৌগে বন্ধনের পোলারিটি যত বেশী হয় এর আর্দ্র বিশ্লেষণের মাত্রাও তত দ্রুত হয়। এর তড়িৎ ঋণাত্মকতার মান হলো তাই অধিক পোলার যেহেতু অপেক্ষা অধিক পোলার তাই অপেক্ষা আর্দ্র বিশ্লেষিত দ্রুত হতে পারে
16 নং গ্রুপের মৌলসমূহের রাসায়নিক ধর্মগুলো উল্লেখ কর। (Chemical properties of group 16 elements)
এ গ্রুপের মৌলগুলো হল- 8O(Oxygen), 16S (Sulphur), 34Se (Selenium), 52Te (Tellurium), 44Po (Polonium), 116Lv (livermorium) এদের যোজ্যতা স্তরের বিন্যাস হলো এদের রাসায়নিক বৈশিষ্ট্যগুলো হল-
১। এরা প্রধানত সমযোজী যৌগ গঠন করে। তবে সালফার এবং অক্সিজেন সালফাইড এবং অক্সাইড আয়নের মাধ্যমে আয়নিক যৌগ গঠন করে। যেমন- ইত্যাদি।
২। এ মৌলগুলোর মধ্যে অক্সিজেন ছাড়া বাকি মৌলগুলো পরিবর্তনশীল যোজনী দেখায়। অক্সিজেনের যোজ্যতা স্তরের d অরবিটাল না থাকায় এটি পরিবর্তনশীল যোজনী দেখায় না। অক্সিজেনের জারণ সংখ্যা হল- তাছাড়া শুধুমাত্র যৌগ বা যৌগে অক্সিজেনের জারণ সংখ্যা হতে পারে। অনুরূপভাবে সালফারের জারণ সংখ্যা হতে পারে। কারণ S এর বহিস্তরে d অরবিটাল আছে।
৩। এ গ্রুপের মধ্যে সালফার এবং পরবর্তী মৌলগুলো অক্সিজেনের সাথে বিক্রিয়া করে অক্সাইড গঠন করে। এদের মধ্যে অধিকাংশ অক্সাইড অম্লধর্মী।
(সোডিয়াম সেলেনাইট)
(সোডিয়াম সেলেনেট)
৪। দ্বিপরমাণুক অক্সিজেন (O2) এ দুটি অক্সিজেন পরমাণু পরস্পরের সাথে দ্বিবন্ধনে যুক্ত থাকায় এরা দ্বিপরমাণুক। তবে অষ্ট পরমাণুক সালফারের মধ্যে ৪টি বন্ধন ভেঙ্গে সালফার পরমাণু তৈরি হতে হয় তাই এক্ষেত্রে আরো বেশি শক্তির প্রয়োজন হয়। তাই এর সক্রিয়তা আরো কম।
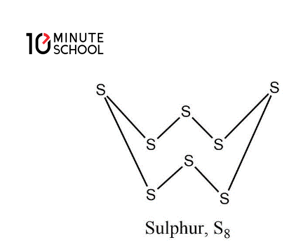
৫। এ গ্রুপের মৌলসমূহ হাইড্রোজেনের সাথে বিক্রিয়া করে হাইড্রাইড গঠন করে।
| তরল
গ্যাস
|
(i) অম্লধর্ম বাড়ে
(ii) বিজারণধর্ম বাড়ে
|
উপরোক্ত যৌগসমূহের ক্ষেত্রে উপর থেকে নিচে গেলে কেন্দ্রীয় পরমাণুর আকার বৃদ্ধি পাওয়ায় কেন্দ্রীয় পরমাণুর সাথে হাইড্রোজেনের বন্ধনটি দুর্বল হতে থাকে। এতে প্রোটন দানের প্রবণতা বৃদ্ধি পায় অর্থাৎ অম্ল ধর্ম বাড়ে। তাই একটি উভধর্মী বা নিরপেক্ষ যৌগ হলেও দুর্বল অম্ল। আবার গ্রুপের উপর থেকে নিচে গেলে অ্যানায়ন সমূহের আকার বৃদ্ধি পাওয়ায় এবং তড়িৎ ঋণাত্মকতার মান হ্রাস পাওয়ায় এর পক্ষে ইলেক্ট্রন দান করা সহজ হয় তাই বিজারণ ধর্মও বৃদ্ধি পায়। যেমন আয়ন অপেক্ষা আয়নের আকার বড় হওয়ায় সহজে ইলেকট্রন দান করতে পারে তাই এটি শক্তিশালী বিজারক তাছাড়া এদের মধ্যে পানি পোলার যৌগ হওয়ার কারণে অসংখ্য পানির অণু পরস্পরের সাথে হাইড্রোজেন বন্ধনের মাধ্যমে যুক্ত থেকে একটি পলিমার অনু বা গুচ্ছ অণু গঠন করে তাই এর ভৌত অবস্থা তরল এবং গলনাঙ্ক ও স্ফুটনাঙ্কের মান সবচেয়ে বেশি। তবে একটি অপোলার যৌগ হওয়ায় এরা একক অণু হিসাবে থাকে তাই এদের মধ্যে দুর্বল ভ্যানডার ওয়ালস আকর্ষণ বল কার্যকর । একক অণু হিসেবে থাকে এ কারণে এর ভৌত অবস্থা গ্যাস।
এ গ্রুপের মৌলসমূহ হ্যালোজেনের সাথে বিক্রিয়া করে। তবে অক্সিজেন শুধুমাত্র ফ্লোরিনের সাথে বিক্রিয়া করে। সালফার মনো, ডাই, টেট্রা, হ্যাক্সা-হ্যালাইড গঠন করতে পারে। যেমন- .
তবে সালফার সর্বোচ্চ জারণ সংখ্যা বা যোজনী উচ্চ তড়িৎ ঋণাত্মক মৌলের উপস্থিতিতেই দেখায়।
একই গ্রুপে অবস্থান করা সত্ত্বেও অক্সিজেনের সমযোজ্যতা স্থির কিন্তু সালফারের সমযোজ্যতা পরিবর্তনশীল কেন?
অথবা, এবং বা এবং এর মধ্যে কোনটি সম্ভব তা কারণসহ ব্যাখ্যা কর। (Existance of , , and )
সমযোজী বন্ধন গঠনের আধুনিক মতবাদ অনুযায়ী কোনো পরমাণুর যোজ্যতা স্তরে যতটা অযুগ্ম অরবিটাল আছে এরা যুগ্ম হওয়ার জন্য তার যতটি ইলেক্ট্রন প্রয়োজন ঐ মৌলের সমযোজ্যতা তত হবে। এ নিয়ম অনুযায়ী উপরোক্ত বিন্যাস হতে বলা যায়, S এর সমযোজ্যতা 2, 4, 6 হবে।
এর যোজ্যতা স্তরে d অরবিটাল না থাকায় এর সমযোজ্যতা শুধুমাত্র 2 হবে। এ কারণে ও গঠিত হলেও ও গঠিত হতে পারে না।
- গঠিত হলে গঠিত হয় না কেন?(Existence of SF6 and SCl6)
সালফার সর্বোচ্চ উদ্দীপিত অবস্থায় যোজনী 6 দেখায়। উচ্চ তড়িৎ ঋণাত্মক মৌল (F, O) এর উপস্থিতিতে এই উদ্দীপিত অবস্থা তৈরি হয়। তাছাড়া ফ্লোরিন (F) পরমাণুর আকার ছোট হওয়ায় একটি সালফার পরমাণুর চারদিকে 6টি ফ্লোরিন অবস্থান করতে পারে। তাই গঠিত হয়। কিন্তু এর তড়িৎ ঋণাত্মকতা কম হওয়ায় এবং এর আকার বড় হওয়ার কারণে একটি সালফার পরমাণুর চারদিকে 6টি ক্লোরিন পরমাণু অবস্থান করে না তাই গঠিত হয় না।
প্রশ্ন: দেখাও যে, একটি জারক, বিজারক এবং বিরঞ্জক হিসেবে কাজ করে।(SO2 as a Oxidant Reductant & Bleach)
জারক হিসেবে : হাইড্রোজেন সালফাইডকে জারিত করে S এ পরিণত করে বলে এটি একটি জারক পদার্থ। এটি একটি সামঞ্জস্যকরণ বিক্রিয়া কারণ এখানে এবং , উভয় সালফারে জারণ সংখ্যা পরিবর্তিত হয়ে একই হয়েছে।
বিজারক হিসেবে : বিজারক হিসেবেও কাজ করতে পারে। যেমন: জলীয় দ্রবণে এটি ক্লোরিনকে বিজারিত করে গঠন করে এবং কে বিজারিত করে এ পরিণত করে।
এর বিরঞ্জন ধর্ম : পানির উপস্থিতিতে গ্যাস জায়মান হাইড্রোজেন উৎপন্ন করে যা রঙিন বস্তুকে বিজারিত করে বিরঞ্জিত করে বলে এটি একটি বিরঞ্জক।
তবে শুষ্ক রঙিন বস্তুতে কোনো পানি না থাকায় কোনো জায়মান হাইড্রোজেন উৎপন্ন করতে পারে না বলে শুষ্ক রঙিন বস্তুকে বর্ণহীন করতে পারে না।
প্রশ্ন: দেখাও যে, গাঢ় একটি জারক এবং নিরুদক পদার্থ।(Concentrated H2SO4 as Oxidant and Dehydrant)
জারণ ধর্ম : গাঢ় এসিড কে জারিত করে এ পরিণত করে এবং নিজে বিজারিত হয়ে এ পরিণত হয়।
নিরুদন ধর্ম : গাঢ় একটি নিরুদক পদার্থ।
প্রশ্ন: অক্সাইডের শ্রেণিবিভাগ আলোচনা কর।(Classification Of Oxides)
১। অম্লধর্মী অক্সাইড : যেসব অক্সাইড পানির সাথে বিক্রিয়া করে এসিড উৎপন্ন করে অথবা ক্ষারের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে তাদেরকে অম্লধর্মী অক্সাইড বলে। যেমন : ইত্যাদি।
(সালফিউরিক এসিড)
২। ক্ষারধর্মী অক্সাইড : যেসব অক্সাইড পানির সাথে বিক্রিয়া করে ক্ষার উৎপন্ন করে অথবা এসিডের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে তাদেরকে ক্ষারধর্মী অক্সাইড বলে। যেমন : ইত্যাদি
৩। উভধর্মী অক্সাইড : যেসব অক্সাইড অম্ল ও ক্ষারক উভয়ের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে তাদেরকে উভধর্মী অক্সাইড বলে। যেমন : ইত্যাদি।
৪। নিরপেক্ষ বা প্রশম অক্সাইড : যেসব অক্সাইড অম্ল ও ক্ষারক কোনোটির সাথেই বিক্রিয়া করে না, তাদেরকে নিরপেক্ষ বা প্রশম অক্সাইড বলে। যেমন : ইত্যাদি।
পার অক্সাইড : যেসব অক্সাইডে স্বাভাবিক অক্সাইডের চেয়ে বেশি পরিমাণে অক্সিজেন থাকে এবং এসিডের সাথে বিক্রিয়া করে হাইড্রোজেন পার অক্সাইড উৎপন্ন করে তাদেরকে পার অক্সাইড বলে। যেমন: সোডিয়াম পার অক্সাইড ক্যালসিয়াম পার অক্সাইড বেরিয়াম পার অক্সাইড () ইত্যাদি।
পার অক্সাইডগুলোতে মূলক বা আয়ন থাকে।
৬। পলি অক্সাইড : যেসব অক্সাইডে স্বাভাবিক অক্সাইডের চেয়ে বেশি পরিমাণে অক্সিজেন থাকে, কিন্তু এসিডের সাথে বিক্রিয়ায় হাইড্রোজেন পার অক্সাইড উৎপন্ন করে না, তাদেরকে পলি অক্সাইড বলে। যেমন : ইত্যাদি ।
৭। সুপার অক্সাইড : যেসব অক্সাইডে পার অক্সাইডের চেয়ে বেশি পরিমাণে অক্সিজেন থাকে তাদেরকে সুপার অক্সাইড বলে। যেমন: পটাশিয়াম সুপার অক্সাইড রুবিডিয়াম সুপার অক্সাইড সিজিয়াম সুপার অক্সাইড ইত্যাদি। সুপার অক্সাইড যৌগে সুপার অক্সাইড আয়ন থাকে।
৮। সাব অক্সাইড : যেসব অক্সাইডে স্বাভাবিক অক্সাইডের চেয়ে কম পরিমাণে অক্সিজেন থাকে, তাদেরকে সাব অক্সাইড বলে। যেমন: কার্বন সাব অক্সাইড , লেড সাব-অক্সাইড ইত্যাদি।
৯। যুগ্ম বা মিশ্র অক্সাইড : যেসব অক্সাইডকে একই মৌলের দু‘টি জারণ সংখ্যাবিশিষ্ট অক্সাইডের মিশ্রণ হিসেবে ধরা যায়, তাদেরকে যুগ্ম বা মিশ্র অক্সাইড বলে। যেমন: ইত্যাদি।
- 17 নং গ্রুপের মৌলসমূহের রাসায়নিক ধর্মগুলো উল্লেখ কর।(Chemical properties of group 17 elements)
এ গ্রুপের মৌলগুলো হলো– । এদের সর্ববহিঃস্থ কক্ষপথের e– বিন্যাস হলো
এর বৈশিষ্ট্যগুলো হল–
১। এরা আয়নিক এবং সমযোজী উভয় প্রকার বন্ধন গঠন করতে পারে।
২। এদের মধ্যে ফ্লোরিন বাদে অবশিষ্ট মৌলগুলোর যোজনী এবং জারণ সংখ্যা পরিবর্তনশীল হয়। কারণ ফ্লোরিনের যোজ্যতা স্তরে কোনো d অরবিটাল নেই। এ কারণে ফ্লোরিনের জারণ সংখ্যা স্থির বা কিন্তু Cl এর জারণ সংখ্যা হল- .
৩। এ গ্রুপের মৌলসমূহের মধ্যে ফ্লোরিন ও ক্লোরিন গ্যাস; ব্রোমিন তরল এবং আয়োডিন কঠিন পদার্থ। সাধারণত গ্রুপের উপর থেকে নিচে গেলে পরমাণুর আকার বৃদ্ধি পায় এবং পারমানবিক সংখ্যা বৃদ্ধির সাথে সাথে ভ্যানডার ওয়ালস আকর্ষণ বলের মান বৃদ্ধি পায়। তাই, ভৌত অবস্থা ক্রমে গ্যাস থেকে কঠিন হয়।
৪। এ গ্রুপের মৌলসমূহ নিজেদের সাথে বিক্রিয়া করে আন্তঃহ্যালোজেন যৌগ গঠন করে। নির্দিষ্ট তাপমাত্রায় ও চাপে দুটি ভিন্ন হ্যালোজেন নিজেদের সাথে যুক্ত হয়ে যে দ্বিমৌল যৌগ গঠন করে তাকে আন্তঃহ্যালোজেন যৌগ বলে। এদেরকে কম তড়িৎ ঋণাত্মক পরমাণুর হ্যালাইড গ্রুপে গণ্য বা বিবেচনা করা হয়। যেমন- ।
| মৌল
|
বর্ণ ও ভৌত অবস্থা
হালকা হলুদ গ্যাস সবুজাভ গ্যাস লালচে বাদামি তরল গাঢ় বেগুনি কঠিন পদার্থ |
৫। হ্যালোজেন গ্রুপের মৌলসমূহের গলনাঙ্ক ও স্ফুটনাঙ্ক এদের পারমাণবিক সংখ্যা বৃদ্ধির সাথে ক্রমশ বৃদ্ধি পায়। কারণ পারমাণবিক সংখ্যা বৃদ্ধির সাথে হ্যালোজেন পরমাণুতে মেঘের বিস্তৃতি ঘটে ফলে হ্যালোজেন অণু () গুলোর মধ্যকার ভ্যানডার ওয়ালস আকর্ষণ বল থেকে এর দিকে ক্রম বৃদ্ধি পায়। এজন্য তাদের গলনাঙ্ক ও স্ফুটনাঙ্ক সে অনুসারে বাড়ে।
৬। এই গ্রুপের মৌলসমূহ পানির সাথে বিক্রিয়া করে তবে গ্রুপের উপর থেকে নিচে গেলে বিক্রিয়ার হার হ্রাস পায়।
[ফ্লোরিন খুব দ্রুত হারে বিক্রিয়া করে]
[ক্লোরিন পানির সাথে আস্তে আস্তে বিক্রিয়া করে]
এ বিক্রিয়াটিকে অম্লীয় অসামঞ্জস্যকরণ বিক্রিয়া বলে বা Disproportion Reaction বলে। যে বিক্রিয়ায় কোনো মৌলের দুটি পরমাণুর যুগপৎ জারণ ও বিজারণ সংগঠিত হয় তাকে অসামঞ্জস্যকরণ বিক্রিয়া বলে।
হ্যালোজেনের ক্ষারীয় অসামঞ্জস্য বিক্রিয়া(Disproportional Reaction of Halogens) : বিভিন্ন অবস্থায় হ্যালোজেন ক্ষারের সাথে অসামঞ্জস্য বিক্রিয়া প্রদর্শন করে। ক্ষারের সাথে হ্যালোজেনের বিক্রিয়ায় হ্যালোজেনের যুগপৎ জারণ বিজারণ উভয়টি সংঘটিত হয় বলে এটি একটি হ্যালোজেনের অসামঞ্জস্য বিক্রিয়া। যেমন-
বা,
থেকে আয়নে পরিণত হওয়ায় এর জারণ অবস্থা থেকে এ হ্রাস পায় অর্থাৎ এর বিজারণ ঘটে। অপরদিকে যখন এ পরিণত হয় তখন তার জারণ অবস্থা থেকে এ বৃদ্ধি পায় অর্থাৎ এর জারণ ঘটে। যেহেতু এক্ষেত্রে এর যুগপৎ জারণ ও বিজারণ উভয়টিই ঘটেছে এ কারণে এটি এর অসামঞ্জস্য বিক্রিয়া।
৭। এ গ্রুপের মৌলসমূহ হাইড্রোজেনের সাথে বিক্রিয়া করে হাইড্রোজেন হ্যালাইড উৎপন্ন করে। এ সমস্ত হ্যালাইডের জলীয় দ্রবণ অম্লধর্মী হয়। তবে গ্রুপের উপর থেকে নিচে গেলে পরমাণুর আকার বৃদ্ধি পায় বলে বন্ধন দুর্বল হতে থাকে। যা সহজে বিয়োজিত হয়ে প্রোটন দান করে তথা অম্লধর্ম বৃদ্ধি পায়। তাই এ সমস্ত হাইড্রোজেন হ্যালাইডসমূহের মধ্যে অম্লধর্মের ক্রম হল-
৮। এ গ্রুপের মৌলসমূহ অক্সিজেনের সাথে বিক্রিয়া করে অক্সাইড গঠন করে। তবে অক্সিজেন শুধুমাত্র অক্সাইড গঠন করে কিন্তু এর পরবর্তী হ্যালোজেনগুলো বিভিন্ন ধরনের অক্সাইড গঠন করে, সে সমস্ত অক্সাইড পানির সাথে বিক্রিয়া করে অক্সো-এসিড উৎপন্ন করে। অক্সোএসিডের কেন্দ্রীয় পরমাণুর ধনাত্মক জারণ সংখ্যা বৃদ্ধি পেলে এসিডের বন্ধন দুর্বল হয়ে দানের প্রবণতা বাড়ে ফলে অম্লধর্মও বাড়ে। যেমন:
(হাইপোক্লোরাস এসিড) অম্লধর্ম
(ক্লোরাস এসিড)
(ক্লোরিক এসিড)
(পারক্লোরিক এসিড) বৃদ্ধি পায়
তবে ফুরিনের কোনো অক্সো-এসিড নেই। কারণ এর জারণ সংখ্যা পরিবর্তনশীল নয় জারণ সংখ্যা ধণাত্মক হয় না। তবে জারণ সংখ্যা সমান হলে এর অম্লধর্ম কেন্দ্রীয় পরমাণুর আকারের উপর নির্ভর করে। তড়িৎ ঋণাত্মকতা যত বেশী হয়, কেন্দ্রীয় পরমাণুর আকার যত ছোট হয় তথা বিচ্যুতি সহজ হয় বলে অম্লধর্ম বাড়ে। তাই
একই গ্রুপে অবস্থান করা সত্ত্বেও ফ্লোরিনের জারণ সংখ্যা স্থির কিন্তু ক্লোরিনের জারণ সংখ্যা বা যোজনী পরিবর্তনশীল কেন? (Oxidation Number of Fluorine and Chlorine)
ক্লোরিনের যোজ্যতাস্তরে d অরবিটাল থাকার কারণে একে উদ্দীপিত করে বিভিন্ন অযুগ্ম অরবিটাল তৈরি করা যায়। তাই এর যোজনী পরিবর্তনশীল।
অপরদিকে F এর যোজ্যতা স্তরে d অরবিটাল না থাকারয় একে উদ্দীপিত করে বিভিন্ন অযুগ্ম ইলেকট্রনযুক্ত অরবিটাল তৈরী করা যায় না তাই এর যোজনী স্থির অর্থাৎ শুধুমাত্র 1 এবং জারণ সংখ্যা .
অধাতুর যোজনী 2 একক করে বাড়ে এবং ধাতুর যোজনী 1 বা 2 একক করে বাড়তে পারে।
বিরঞ্জক হিসেবে ও এর তুলনা কর( & as Bleach):
| ১. পানির সংস্পর্শে বিরঞ্জক হিসেবে কাজ করে | ১. পানির সংস্পর্শে বিরঞ্জক হিসেবে কাজ করে
|
| ২. পানির সাথে বিক্রিয়া করে জায়মান হাইড্রোজেন উৎপন্ন করে যা রঙিন বস্তুকে বিজারিত করে বর্ণহীন করে
|
২. পানির সাথে বিক্রিয়া করে জায়মান অক্সিজেন উৎপন্ন করে যা রঙিন বস্তুকে বিজারিত করে বর্ণহীন করে।
|
| ৩. এর বিরঞ্জন ক্রিয়া অস্থায়ী । বিরঞ্জিত বস্তুকে বায়ুতে রেখে দিলে পূর্বের রঙ ফিরে আসে | ৩. এর বিরঞ্জন ক্রিয়া স্থায়ী। বিরঞ্জিত বস্তুকে বায়ুতে রেখে দিলে পূর্বের রঙ ফিরে আসে না। |
| ৪. ক্লোরিন অপেক্ষা মৃদু বিরঞ্জক | ৪. সালফার ডাইঅক্সাইড অপেক্ষা তীব্র বিরঞ্জক |
প্রশ্ন: হ্যালোজেন সমূহের মধ্যে ফ্লোরিন সর্বাধিক সক্রিয় কেন? (Fluorine’s Reactivity)
দ্বিপরমাণুক হ্যালোজেন অণুর বন্ধন বিযোজন শক্তি বলতে বন্ধন শক্তিকে বোঝায়। হ্যালোজেনসমূহের মধ্যে ফ্লোরিন পরমাণুর আকার সবচেয়ে ছোট। তাই ফ্লোরিন অণুর সমযোজন ব্যাসার্ধ সবচেয়ে কম; প্রায় । ক্লোরিন অণু ও ব্রোমিনু অণুর সমযোজন ব্যাসার্ধ যথাক্রমে এবং . অর্থাৎ অণু সবচেয়ে বেশি স্থায়ী অণু হওয়ায় এর বিযোজন শক্তি সবচেয়ে বেশি হওয়া উচিত। কিন্তু বাস্তবে এর বন্ধন বিযোজন শক্তি ()। ও এর বন্ধন বিযোজন শক্তি (যথাক্রমে ) অপেক্ষা কম এবং আয়োডিনের প্রায় সমান । এর কারণ হল এর উভয় পরমাণুর অরবিটালের নিঃসঙ্গ ইলেকট্রনের পারস্পরিক বিকর্ষণের পরিমাণ এর উভয় পরমানুর 3p অরবিটালের নিঃসঙ্গ ইলেকট্রনের বিকর্ষণের পরিমাণ থেকে বেশি। ফলে সমযোজী বন্ধন তুলনামূলকভাবে দুর্বল হয় এবং ফ্লোরিন অণু সবচেয়ে কম স্থায়ী । উল্লেখ্য, ফ্লোরিন অণুর নিম্ন বন্ধন বিযোজন শক্তি () এবং এর সর্বাধিক তড়িৎ ঋণাত্মকতা মিলে ফ্লোরিন সবচেয়ে অধিক সক্রিয় মৌলে পরিণত হয়েছে। অপরদিকে ক্লোরিন অণু () এর বন্ধন বিযোজন শক্তি হ্যালোজেনসমূহের মধ্যে সবচেয়ে বেশি (প্রায়)। ফলে এর সমযোজী বন্ধন () এর স্থায়িত্ব সবচেয়ে বেশি।
নিষ্ক্রিয় গ্যাসের অণুসমূহ এক পরমাণুক কেন? (Why are noble gases mono-molecular)
নিষ্ক্রিয় গ্যাসের অণুসমূহ এক পরমাণুক নিম্নোক্ত কারণে-
১। তাত্ত্বিকভাবে প্রমাণিত হয়েছে যে, যে সমস্ত গ্যাসের অণু এক পরমাণুক তাদের ক্ষেত্রে এর মান 1.67 হয়। পরীক্ষা লব্ধ মান হতে দেখা যায় যে, নিষ্ক্রিয় গ্যাসসমূহের ক্ষেত্রে এ মান 1.64 থেকে 1.69 এর মধ্যে থাকে, যা থেকে প্রমাণিত হয় নিষ্ক্রিয় গ্যাসের অণুসমূহ এক পরমাণুক।
২। STP তে সকল গ্যাসের মোলার আয়তন লিটার। দেখা যায় যে, নিষ্ক্রিয় গ্যাসসমূহের যে পরিমাণ লিটার আয়তন দখল করে তা এদের পারমানবিক ভরের সমান। অর্থাৎ এতেও প্রমাণিত হয় নিষ্ক্রিয় গ্যাসের অণু এক পরমাণুক।
৩। নিষ্ক্রিয় গ্যাসসমূহে বহিঃস্তরে অষ্টক পূর্ণ থাকায় এরা সহজে অন্য কোনো মৌলের সাথে এমনকি নিজেরা নিজেদের সাথেও যুক্ত হতে চায় না। এ কারণেও এরা এক পরমাণুক।
- নিষ্ক্রিয় গ্যাসসমূহের নিষ্ক্রিয়তার কারণ কী? (Noble gases and their Stability)
১। ইলেকট্রন বিন্যাসজনিত কারণ : নিষ্ক্রিয় গ্যাসসমূহের ইলেকট্রন বিন্যাস নিম্নরূপ-
তাছাড়া এবং ও নিষ্ক্রিয় গ্যাস।
উপরোক্ত বিন্যাস হতে দেখা যায় যে, এদের যোজ্যতা স্তরে Duplet বা Octet পূর্ণ থাকায় এরা নিজেদের সাথে এমনকি অন্য কোনো পরমাণুর সাথে যুক্ত হতে চায় না। তাই এরা নিষ্ক্রিয়।
২। আয়নিক বন্ধন গঠন না করার কারণ : নিষ্ক্রিয় গ্যাসমূহের আয়নিকরণ বিভবের মান সবচেয়ে বেশি এবং ইলেকট্রন আসক্তির মান প্রায় শূন্য হওয়ায় এদেরকে সহজে ধণাত্মক বা ঋণাত্মক আয়নে পরিণত করা যায় না। আয়ন গঠিত না হওয়ার কারণে এরা আয়নিক বন্ধনও গঠন করতে পারে না।
৩। সমযোজী বন্ধন গঠন না করার কারণ : এদের যোজ্যতা স্তরের সাধারণত ইলেক্ট্রন বিন্যাস হল বা এ বিন্যাস হতে দেখা যায়, এদের যোজ্যতাস্তরে কোনো অযুগ্ম ইলেকট্রনযুক্ত অরবিটাল নেই। তাই এরা সমযোজী বন্ধন গঠন করে না।
অতএব, এরা আয়নিক বা সমযোজী বন্ধন যৈাগ গঠন করতে পারে না বলেই এরা নিষ্ক্রিয়।
- নিষ্ক্রিয় গ্যাসসমূহ দ্বারা গঠিত সমযোজী যৌগের সংক্ষিপ্ত বর্ণনা দাও।(Covalent Compounds with Noble gases)
(i) সমযোজী যৌগ : স্বাভাবিক অবস্থায় নিক্রিয় গ্যাসসমূহ রাসায়নিকভাবে নিষ্ক্রিয় হলেও উদ্দীপিত অবস্থায় বা বিশেষ অবস্থায় এরা সমযোজী যৌগ গঠন করতে পারে। এ সমস্ত পরমাণুর আকার যতই বড় হতে থাকে উদ্দীপিত করা ততই সহজ হয় বলেই এদের মধ্যে Xenon সবচেয়ে বেশি সক্রিয়। তবে এরা সর্বোচ্চ তড়িৎ ঋণাত্মক মৌল যেমন- F এবং O এর উপস্থিতিতে সমযোজী যৌগ গঠন করতে পারে। এদের দ্বারা গঠিত সমযোজী যৌগগুলো নিম্নরূপ-
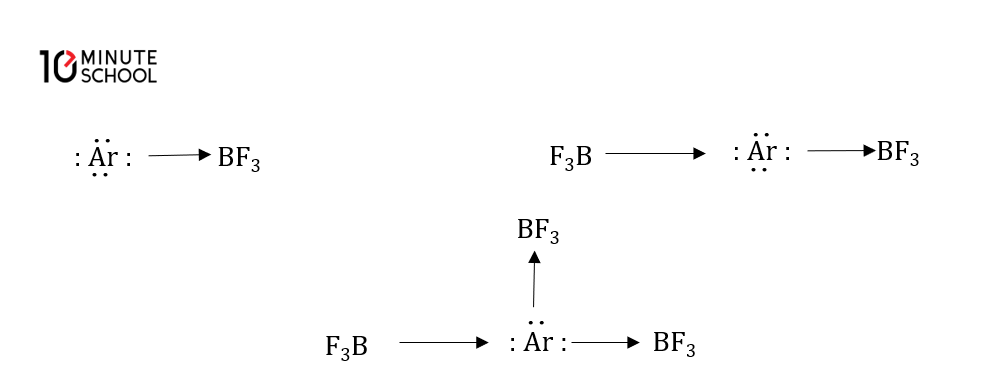
(ii) সন্নিবেশ যৌগ গঠন : নিক্রিয় গ্যাসের পরমাণুতে মুক্ত জোড় ইলেকট্রন দ্বারা উপযুক্ত পরিবেশে শক্তিশালী ইলেকট্রন গ্রহীতার উপস্থিতিতে ইলেকট্রন দান করে যৌগ গঠন করতে পারে। যেমনঃ
(iii) শক্তিশালী ডাইপোল (Dipole) যৌগ : যেমন পানির প্রভাবে উচ্চ চাপ ও নিম তাপমাত্রায় নিষ্ক্রিয় গ্যাসসমূহ পোলারিত হয়। ফলে নিষ্ক্রিয়। গ্যাসের পরমাণুগুলো দুর্বল আবেশীয় ডাইপোলের মতো ক্রিয়া করে পানি যোজিত বা হাইড্রেটেড যৌগ গঠন করে যেমন :
(iv) ক্যাথরেট (Cathrate) বা অবরোধ যৌগ গঠন : ১৯৫০ সালে বিজ্ঞানী এইচ, এম, পাউয়েল (H. M. Powel) দেখান যে, এমন কতগুলো বিশেষ ধরনের জৈব বা অজৈব যৌগ আছে যাদের কেলাস-জালকের ফাঁকা স্থানের মধ্যে নিষ্ক্রিয় গ্যাস মৌল আটক বা অবরুদ্ধ অবস্থায় থাকতে পারে। এই যৌগগুলোকে ক্যাথরেট বা অবরোধ যৌগ বলা হয়। যেমন- Ar, Kr ও Xe এর সাথে কুইনলের সংযোগে ক্যাথরেট যৌগ গঠন করে।