গ্যালভানিক কোষ বা ডেনিয়েল কোষ
গঠন ও ক্রিয়া কৌশল (Structure and Functioning technique)
কোষটিতে স্বতঃস্ফূর্তভাবে জারণ– বিজারণ বিক্রিয়ার মাধ্যমে বিদ্যুৎ উৎপাদন করা যায়।
যে তড়িৎ রাসায়নিক কোষে তড়িৎদ্বার বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটে এবং রাসায়নিক শক্তি বিদ্যুৎ শক্তিতে রূপান্তর হয় তাকে গ্যালভানিক কোষ (Galvanic Cell) বলে।
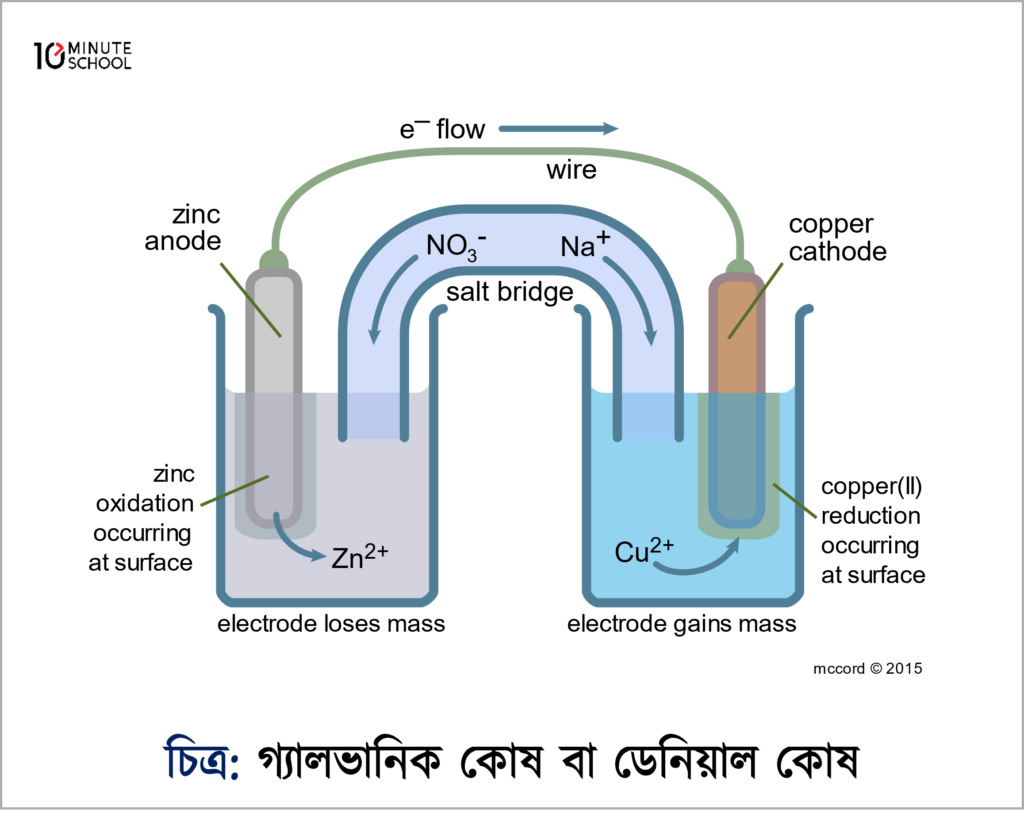
ডেনিয়েল কোষের একটি পাত্রে কপার সালফেট \mathrm{CuSO_4} এর জলীয় দ্রবণে ক্যাথোড হিসেবে কপার দণ্ড এবং অপর একটি পাত্রে জিংক সালফেট \mathrm{ZnSO_4} এর জলীয় দ্রবণে জিঙ্ক অ্যানোড হিসেবে নেওয়া হয়। এরপর পাত্র দুটিকে পাশাপাশি রেখে লবণ সেতুর মাধ্যমে সংযোগ করলে নিম্নোক্ত জারণ বিজারণ বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটবে।
ক্যাথোড এ বিক্রিয়া: \mathrm{Cu^{2+}+2e^-\rightarrow Cu} বিজারণ বিক্রিয়া
অ্যনোড এ বিক্রিয়া: \mathrm{Zn\rightarrow Zn^{2+}+2e^-} জারণ বিক্রিয়া
সার্বিক বিক্রিয়া: \mathrm{Zn+CuSO_4\rightarrow ZnSO_4+Cu}
এখন তারা তড়িৎদ্বার দুটিকে সংযুক্ত করলেই অ্যানোড থেকে ক্যাথোডে ইলেকট্রনের প্রবাহের সৃষ্টি হবে। আর ইলেকট্রন প্রবাহ মানে বিদ্যুৎপ্রবাহ এজন্য ডেনিয়েল সেলে বাইরের তারের সাথে বৈদ্যুতিক বাল্ব যুক্ত করলে বাতি জ্বলে উঠবে।
গ্যালভানিক কোষ বা ডেনিয়েল কোষ এর গুরুত্ব (Importance of Galvanic Cell or Daniel Cell)
অ্যানোড ও ক্যাথোড পাত্রে বিদ্যমান আয়নসমূহের অসমতা দূর করার জন্য লবণ সেতুর প্রয়োজনীয়তা অনেক। আমরা জানি কোনো একটি বিশেষ আয়ন একা থাকতে পারে না। অর্থাৎ একটি ক্যাটায়ন একটি আয়নের উপস্থিতি ছাড়া তৈরি হয় না। সুতরাং অ্যানোড উৎপন্ন \mathrm{Zn^{2+}(aq)} আয়নের সমতূল্য পরিমাণ সালফেট \mathrm{SO_4^{2-}} আয়ন প্রয়োজন হবে। একইভাবে ক্যাথোড পাত্রের দ্রবণ থেকে \mathrm{Cu^{2+}} আয়ন কপার ধাতু হিসেবে জমা হবে এবং সামান্য পরিমাণ \mathrm{SO_4^{2-}} আয়ন মুক্ত হবে।
ফলে একদিকে অ্যানোড পাত্রে ক্যাটায়ন \mathrm{Zn^{2+}} অপরদিকে ক্যাথোড পাত্রে অ্যানায়ন \mathrm{SO_4^{2-}} আধিক্য ঘটবে। প্রকৃতপক্ষে 2 পাত্রের মধ্যে আয়নের সমতা বজায় না থাকলে বিক্রিয়া ঘটবে না। এক্ষেত্রে লবণ সেতু হিসেবে \mathrm{KCl} দ্রবণ ব্যবহার করলে ধনাত্মক ও ঋণাত্মক আয়নের সাহায্যে ক্যাথোড ও অ্যানোড সমতা রক্ষা করে। উপরের আলোচনা থেকে এটা স্পষ্ট যে কোষ এ লবণ সেতুর গুরুত্ব অপরিসীম।
গ্যালভানিক কোষ ও তড়িৎ বিশ্লেষ্য কোষের মধ্যে পার্থক্য (Difference between Galvanic Cell and Electrolytic Cell)
| গ্যালভানিক কোষ বা তড়িৎ রাসায়নিক কোষ (Galvanic Cell) | তড়িৎ বিশ্লেষ্য কোষ (Electrolytic Cell) |
| ১. যে তড়িৎ রাসায়নিক বিক্রিয়ার শক্তি বিদ্যুৎ শক্তিতে রূপান্তরিত হয় তাকে গ্যালভানিক কোষ বা তড়িৎ রাসায়নিক কোষ (Galvanic Cell) বলে | ১. যে তড়িৎ কোষে বাইরের উৎস হতে বিদ্যুৎ প্রবাহের ফলে রাসায়নিক বিক্রিয়া ঘটে তাকে তড়িৎ বিশ্লেষ্য কোষ (Electrolytic Cell)বলা হয় |
| ২. গ্যালভানিক কোষ বা তড়িৎ রাসায়নিক কোষ চল তড়িৎ শক্তি উৎপাদিত কোষ | ২. তড়িৎ বিশ্লেষ্য কোষ হলো তড়িৎ শক্তি ব্যায়িত কোষ |
| ৩. গ্যালভানিক কোষের বাহ্যিক বর্তনীতে কোন পরিবাহীতার থাকলেই চলে বিদ্যুৎ উৎস যেমন ব্যাটারি যুক্ত থাকে না | ৩. তড়িৎ বিশ্লেষ্য কোষ এর বাহ্যিক বর্তনীতে তড়িৎচালক বলের উৎস যেমন ব্যাটারি যুক্ত থাকতে হয় |
| ৪. গ্যালভানিক কোষের অ্যানোড (–ve) ও ক্যাথোড ধনাত্মক (+ve) | ৪. তড়িৎ বিশ্লেষ্য কোষের অ্যানোড ধনাত্মক ও ক্যাথোড ঋনাত্নক |
| ৫. দুটি ভিন্ন পাত্রে দুটি ভিন্ন তড়িৎ বিশ্লেষ্য এর মধ্যে তড়িৎদ্বার দুটি থাকে | ৫. একই পাত্রে তড়িৎ বিশ্লেষ্য পদার্থের মধ্যে তড়িৎদ্বার থাকতে পারে |
ড্রাইসেল এর গঠন (Structure of Dry Cell)
ড্রাইসেল এ অ্যানোড হিসেবে সাধারণত ধাতব জিংকের এর তৈরি ছোট কৌটা ব্যবহার করা হয়। ম্যাঙ্গানিজ ডাই অক্সাইড \mathrm{(MnO_2)}, অ্যামোনিয়াম ক্লোরাইড \mathrm{(NH_4Cl)}, জিংক ক্লোরাইড \mathrm{(ZnCl)} ও পাতিত পানি মিশ্রিত করে প্রস্তুতকৃত কাই দ্বারা জিংকের তৈরি ছোট কৌটা পূর্ণ করা হয়। এরপর জিংক এর মাঝখানে একটি কার্বন দন্ড প্রবেশ করানো হয়। কার্বন দন্ড ক্যাথোড হিসেবে কাজ করে। ড্রাইসেলের অ্যানোডে জিংক দুটি ইলেকট্রন ত্যাগ করে \mathrm{Zn^{2+}} এ পরিণত হয়।
অ্যানোডে জারণ বিক্রিয়া:
\mathrm{Zn} \rightarrow \mathrm{Zn}^{2+}+2 e^{-}
অ্যানোড এ উৎপন্ন দুটি ইলেকট্রন তারের মধ্য দিয়ে কার্বন দন্ডে চলে আসে এবং কার্বন দন্ড দুটি ইলেকট্রন অ্যামোনিয়াম ক্লোরাইড থেকে প্রাপ্ত অ্যামোনিয়াম আয়ন \left(\mathrm{NH}_4\right)^{+} এবং ম্যাঙ্গানিজ ডাই অক্সাইড \left(\mathrm{MnO}_2\right) গ্রহণ করে অ্যামোনিয়া গ্যাস এবং ম্যাঙ্গানিজ ডাই অক্সাইড \left(\mathrm{MnO}_2\right) উৎপন্ন করে।
ক্যাথোড এ বিজারণ বিক্রিয়া:
2 \mathrm{NH}_4{ }^{2+}+2 \mathrm{Mn}_2 \mathrm{O}_3+2 e^{-} \rightarrow 2 \mathrm{NH}_3+\mathrm{Mn}_2 \mathrm{O}_3+\mathrm{H}_2 \mathrm{O}
সামাগ্রিক কোষ বিক্রিয়া:
\mathrm{Zn}+2 \mathrm{NH}^{+}{ }_4+2 \mathrm{MnO}_2 \rightarrow \mathrm{Zn}^{2+}+2 \mathrm{NH}_3+\mathrm{Mn}_2 \mathrm{O}_3+\mathrm{H}_2 \mathrm{O}
