প্রমাণ তাপমাত্রা ও চাপ এবং আদর্শ গ্যাস সমীকরণ বা গ্যাস সূত্রাবলির সমন্বয় (Standard Temperature and Pressure and Ideal gas equation)
আদর্শ গ্যাস সমীকরণ বা গ্যাস সূত্রাবলির সমন্বয় pV=nRT (Ideal Gas equation : pV=nRT)
m ভরের কোনো গ্যাসের আয়তন, চাপ ও পরম তাপমাত্রা যথাক্রমে V, p এবং T।
বয়েলের সূত্র থেকে আমরা পাই, V \propto \frac{1}{p} , যখন m এবং T ধ্রুব
এবং চার্লসের সূত্র থেকে আমরা পাই, V \propto T, যখন m এবং p ধ্রুব।
অনুপাতের সূত্রানুসারে,
V \propto \frac{T}{p} যখন m ধ্রুব
V=K \frac{T}{p}বা, \frac{p V}{T}=K
বা, p V=K T
এখানে K একটি ধ্রুব সংখ্যা, এর মান গ্যাসের ভর, m উপর নির্ভর করে।
যদি T_{1}, T_{2} ……… T_{n} কেলভিন তাপমাত্রায় এবং P_{1}, P_{2} ……… P_{n} চাপে কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন যথাক্রমে V_{1}, V_{2} ……… V_{n} হয়, তাহলে উপরিউক্ত সমীকরণ অনুসারে,
\frac{p_{1} V_{1}}{T_{1}}=\frac{p_{2} V_{2}}{T_{2}}=\ldots \ldots \ldots=\frac{p_{n} V_{n}}{T_{n}}=K, \quad \text { ধ্রুবক } … … …(10.6)
যদি এক মোল (mole) বা এক গ্রাম অণু গ্যাস বিবেচনা করা হয় তাহলে সকল গ্যাসের জন্য এই ধ্রুব সংখ্যার মান একই হয়। তখন এই ধ্রুবককে R দিয়ে নির্দেশ করা হয়, অন্যক্ষেত্রে একে K দিয়ে প্রকাশ করা হয়।
সুতরাং এক মোল গ্যাসের জন্য \frac{p V}{T}=R
বা, p V=R T … … …(10.7)
এক মোল বা এক গ্রাম গ্যাস না নিয়ে m পরিমাণ গ্যাস নোওয়া হয় যার আয়তন V এবং ঐ গ্যাসের আণবিক ভর যদি M হয়, তবে এক মোল বা এক গ্রাম অণু গ্যাসের আয়তন হবে \frac{M}{m} V। সুতরাং (10.7) সমীকরণে V-এর পরিবর্তে \frac{M}{m} V বসিয়ে আমরা পাই,
p \frac{M}{m} V=R Tবা, \text { বা, } p V=\frac{m}{M} R T … … …(10.8)
কিন্তু \frac{m}{M} হচ্ছে গ্যাসের মোলের সংখ্যা যা পূর্ণ সংখ্যা বা ভগ্নাংশ হতে পারে। একে n দিয়ে প্রকাশ করা হলে উপরিউক্ত সমীকরণ দাঁড়ায়,
p V=n R T … … …(10.9)
এটি হচ্ছে বয়েল ও চার্লসের সূত্রের সংযুক্ত রূপ। এ সমীকরণকে সাধারণত গ্যাস সমীকরণ বা আদর্শ গ্যাসের অবস্থার সমীকরণ বলা হয়।
যে সকল গ্যাস বয়েল ও চার্লসের সূত্র যুগ্মভাবে (অর্থাৎ 10.9 সমীকরণ) মেনে চলে তাদেরকে আদর্শ গ্যাস বলে। কেবলমাত্র নিম্নচাপ ও উচ্চ তাপমাত্রায় গ্যাস এ সমীকরণ মেনে চলে।
দেখাও যে, একক চাপে কোনো আদর্শ গ্যাসের এক মোলের আয়তন বনাম পরম তাপমাত্রা লেখচিত্রের ঢালই হচ্ছে সর্বজনীন গ্যাস ধ্রুবক R।
এক মোল গ্যাসের জন্য আদর্শ গ্যাস সমীকরণ হচ্ছে pV=RT
একক চাপের ক্ষেত্রে p=1 একক
∴V=RT অর্থাৎ V \propto T
বা,\frac{V}{T}=R
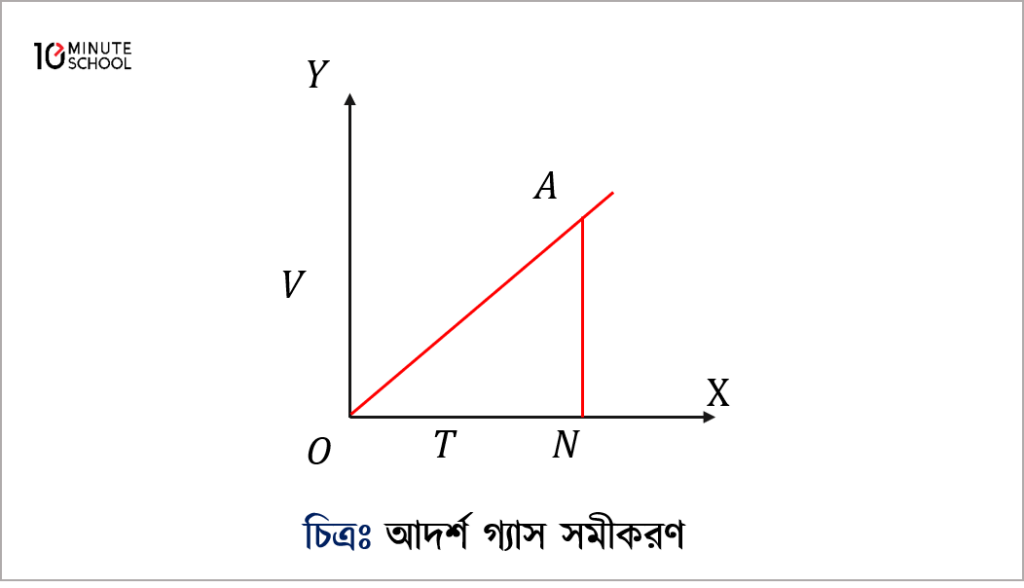 এখন X-অক্ষের দিকে পরম বা কেলভিন তাপমাত্রা T এবং Y-অক্ষের দিকে একক চাপে এক মোল গ্যাসের আয়তন নিয়ে লেখচিত্র আঁকলে সেটি মূলবিন্দুগামী সরলরেখা হবে (চিত্র : ১০.৩)। এই সরলরেখা X-অক্ষের সাথে যে কোণ উৎপন্ন করে তার ট্যানজেন্টই হচ্ছে V-T রেখার ঢাল।
এখন X-অক্ষের দিকে পরম বা কেলভিন তাপমাত্রা T এবং Y-অক্ষের দিকে একক চাপে এক মোল গ্যাসের আয়তন নিয়ে লেখচিত্র আঁকলে সেটি মূলবিন্দুগামী সরলরেখা হবে (চিত্র : ১০.৩)। এই সরলরেখা X-অক্ষের সাথে যে কোণ উৎপন্ন করে তার ট্যানজেন্টই হচ্ছে V-T রেখার ঢাল।
সরল রেখার উপরস্থ A বিন্দু থেকে Y-অক্ষের উপর অঙ্কিত লম্ব AN।
এখন ON=T ধরলে AN=V হবে।
সুতরাং OA রেখার ঢাল =\tan \angle A O N=\frac{A N}{O N}
V-T রেখার ঢাল =\frac{A N}{O N}=\frac{V}{T}=R
অর্থাৎ একক চাপের গ্যাসের এক মোলের আয়তন বনাম পরম তাপমাত্রা লেখচিত্রের ঢালই হচ্ছে ঐ গ্যাসের সর্বজনীন গ্যাস ধ্রুবক।
প্রমাণ তাপমাত্রা ও চাপ (Standard Temperature and Pressure)
প্রমাণ তাপমাত্রা (Standard temperature) :
যে তাপমাত্রায় প্রমাণ চাপে বরফ গলে পানিতে পরিণত হয় বা পানি জমে বরফে পরিণত হয় সেই তাপমাত্রাকে প্রমাণ তাপমাত্রা বলে। সেলসিয়াস স্কেলে এটি0^{\circ} \mathrm{C} এবং কেলভিন এককে 273.15 \mathrm{~K}
প্রমাণ চাপ (Standard Pressure) :
সমুদ্রপৃ্ষ্ঠে 45° অক্ষাংশে 273.15 \mathrm{~K} তাপমাত্রায় উল্লম্বভাবে অবস্থিত 760 mm উচ্চতা বিশিষ্ট শুষ্ক ও বিশুদ্ধ পারদস্তম্ভ যে চাপ দেয় তাকে প্রমাণ চাপ বলে।
\begin{aligned} \therefore \text { প্রমাণ চাপ } &=760 \mathrm{~mm} \text { পারদস্তম্ভ চাপ } \\ &=0.76 \mathrm{~m} \times 13596 \mathrm{~kg} \mathrm{~m}^{-3} \times 9.806 \mathrm{~ms}^{-2} \\ &=1.013 \times 10^{5} \mathrm{Nm}^{-2} \\ &=1.013 \times 10^{5} \mathrm{~Pa} \end{aligned}চাপের বিভিন্ন এককের মধ্যে সম্পর্ক (Relationship between different units of pressure)
1 বায়ুমন্ডলীয় চাপ =1.013 \times 10^{5} \mathrm{Nm}^{-2}=1.013 \times 10^{5} \mathrm{~Pa}=760 \mathrm{~mm} পারদ চাপ =76 \mathrm{~cm} পারদ চাপ। প্রমাণ তাপমাত্রা ও চাপ পূর্বে স্বাভাবিক তাপমাত্রা ও চাপ বা N.T.P নামে পরিচিত ছিল।
