সারফেস ওয়াটারের বিশুদ্ধতার মানদণ্ড
সারফেস ওয়াটারের বিশুদ্ধতার মানদণ্ড (Purity Criteria of Surface water)
প্রশ্ন-২২ : ভূ-পৃষ্ঠীয় পানি বা সারফেস ওয়াটারের বিশুদ্ধতার মানদণ্ড উল্লেখ কর।
উত্তর : বিশুদ্ধতার মানদণ্ডগুলো হল-
(i) পানির খরতা
(ii) পানির pH
(iii) DO বা Dissolved Oxygen
(iv) BOD বা Biochemical Oxygen Demand
(v) COD বা Chemical Oxygen Demand
(vi) TDS বা Total Dissolved Solid
নিম্নে সংক্ষিপ্ত বর্ণনা দেয়া হল-
(i) পানির খরতা : যে ধর্মগুণে কোন পানি সাবানের সাথে সহজে ফেনা উৎপন্ন করে না যথেষ্ট সাবান খরচের পর উৎপন্ন করে সে ধর্মকে খরতা বলে। পানিতে \mathrm{Ca}^{2+}, \mathrm{Mg}^{2+}, \mathrm{Fe}^{2+}, \mathrm{HCO}^{3-} আয়ন দ্রবীভূত থাকলে অস্থায়ী এবং \mathrm{Ca}^{2+}, \mathrm{Mg}^{2+}, \mathrm{Fe}^{2+}, \mathrm{Cl}^{-}, \mathrm{SO}_{4}^{-2} আয়ন দ্রবীভূত থাকলে পানি স্থায়ী খর হয়। স্ফুটন পদ্ধতির মাধ্যমে অস্থায়ী খরতা দূর করা যায়।
কিন্তু রাসায়নিক পদ্ধতিতে যেমন বিনিময় বা পারমুটিট পদ্ধতিতে স্থায়ী খরতা দূর করা যায়। তবে পানিতে \mathrm{Ca}^{2+} ও\mathrm{Mg}^{2+} এর সমষ্টিকে পানির খরতা বলে। এদের পরিমাণ 150 ppm বা এর বেশি হলে এই পানি খর পানির পর্যায়ে পড়ে।
WHO কর্তৃক পানযোগ্য পানির খরতার মান হল 500 ppm।
(ii) পানির pH : WHO কর্তৃক পানযোগ্য পানির pH এর মান হল 6.5-8.5। তবে বাংলাদেশের জন্য আদর্শ মান হল 6.5-9.2। বিভিন্ন জলজ প্রাণীর বসবাস উপযোগী পানির pH মান হল 6.5-8.5 বা 8.5 এর চেয়ে কম বা বেশি হয়। pH এর মান 4.5 থেকে এবং 9.5 থেকে বেশি হলে তা জীবের জন্য প্রাণঘাতী হয়। pH মিটারের সাহায্যে পানির pH নির্ণয় করা হয়।
(iii) DO : পানিতে বিভিন্ন অণুজীব, জলজ প্রাণী ও উদ্ভিদের জীবনযাপনের জন্য যে পরিমাণ \mathbf{0}_{2} পানিতে দ্রবীভূত থাকা প্রয়োজন তাকে ঐ পানির DO বলা হয়। এর আদর্শ মান হল 4-6 ppm তবে এর মান 2-3 ppm এর কম হলে ঐ পানিকে দূষিত পানি বলা হয়। আয়োডোমিতি পদ্ধতিতে DO এর পরিমাণ নির্ণয় করা হয়।
(iv) BOD : একটি নির্দিষ্ট তাপমাত্রা ও নির্দিষ্ট সময়ে কোন পানিতে বিদ্যমান aerobic বা বায়বীয় ভাঙ্গনযোগ্য বা biodegradeable অণুজীব কর্তৃক জৈব দূষক পদার্থ সমূহকে বিয়োজিত করতে প্রয়োজনীয় \mathbf{0}_{2} এর পরিমাণকে প্রাণ রাসায়নিক অক্সিজেন চাহিদা বা BOD বলা হয়।
দূষিত পানির প্রতি লিটারে উপস্থিত জৈব পদার্থ সমূহের ব্যাকটেরিয়া ঘটিত বিয়োজন এর জন্য যত মিলিগ্রাম \mathbf{0}_{2} প্রয়োজন হয় সেই সংখ্যাটিকে ঐ পানির BOD বলা হয়। WHO কর্তৃক পানযোগ্য পানিতে BOD এর মান 6 ppm। বিশুদ্ধ ও পানযোগ্য জল হিসেবে ব্যবহৃত পানির BOD এর মান 1-2 ppm হলে সবচেয়ে ভাল হয়।
জৈববস্তু + অক্সিজেন ব্যাকটেরিয়া→ \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}+\mathrm{H}_{2}+\mathrm{NH}_{3}
পানিতে BOD এর মান বৃদ্ধি পেলে DO এর মান হ্রাস পায়।
(v) COD : পানিতে উপস্থিত বিয়োজন যোগ্য এবং বিয়োজন অযোগ্য জৈব দূষক পদার্থসমূহকে তীব্র জারক পদার্থ যেমন – \mathrm{H}_{2} \mathrm{SO}_{4} \text { যুক্ত } \mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7} দ্বারা সম্পূর্ণ জারিত করতে প্রয়োজনীয় \mathbf{0}_{2} এর মোট পরিমাণকে প্রাণ রাসায়নিক \mathbf{0}_{2} চাহিদা বা COD বলে। এটি একটি রাসায়নিক প্রক্রিয়া (COD এর মান বৃদ্ধি পেলে পানি দূষণের হার বৃদ্ধি পায়)।
(vi) TDS : ভূপৃষ্ঠের পানিকে 103℃ তাপমাত্রায় উত্তপ্ত করে বাষ্পীভূত করলে পরিত্যাক্ত বা কঠিন অবশেষকে TDS বলে। WHO কর্তৃক পানযোগ্য পানিতে TDS এর মান হল 500 ppm। TDS এর প্রধান উৎস হল বিভিন্ন শিল্প কারখানায় বর্জ্য পদার্থগুলো। জৈব ও অজৈব এসিডের ধাতব লবণ ছাড়াও কখনো কখনো ভারী ধাতু মিশ্রিত থাকে। সাধারণত প্রতি লিটার পানিতে দ্রবীভূত বা কলয়ডাল অবস্থায় থাকা সব ধরণের কঠিন পদার্থের মোট পরিমাণ হল TDS।
প্রশ্ন-২৩ : পানির BOD মান হতে পানির দূষণ প্রকৃতি সম্পর্কে কি ধারণা পাওয়া যায় ?
উত্তর : BOD এর মান হতে পাওয়া যায়, পানিতে দ্রবীভূত \mathbf{0}_{2} এর পরিমাণ কতটা কমে গেছে এবং কতটা কমলে ঐ পানিতে জলজ প্রাণী আর বেঁচে থাকবে না। BOD এর মান বৃদ্ধি পেলে DO এর মান হ্রাস পায়। BOD এর মান হতে পানি দূষণের সঠিক মাত্রা নিরূপিত হয় না। কারণ এ পদ্ধতিতে অণুজীব দ্বারা Non-Biodegradeable বা অবিয়োজন যোগ্য জৈব দূষক গুলো জারিত হয় না। এ ধরণের দূষক BOD এর হিসেবে আসে না। তাই BOD এর মান দূষণের সঠিক তথ্য দেয় না।
প্রশ্ন-২৪ : পানির খরতা নির্ণয়ের পদ্ধতি বর্ণনা কর।
উত্তর : পানিতে প্রাধান্য বিস্তারকারী ক্যাটায়ন হিসেবে \mathrm{Ca}^{2+} এবং \mathrm{Mg}^{2+} আয়নের সমষ্টিকে খরতা বলে। তবে পানিতে দ্রবীভূত Ca লবণ থেকে অধঃক্ষিপ্ত \mathrm{CaCO}_{3} এর পরিমাণ দ্বারা পানির খরতা প্রকাশ করা হয়। পানিতে প্রতি দশ লক্ষ ভাগের মধ্যে যত ভাগ ভরের \mathrm{CaCO}_{3} লবণ অধঃক্ষিপ্ত হয়। ঐ পরিমাণ ভরকে ঐ পানির খরতার মাত্রা বলে। তবে \mathrm{Ca}^{2+} লবণ না থাকলে অন্যান্য লবণ যেমন M g^{2+}, F e^{2+} প্রভৃতি লবণ থেকে অধঃক্ষিপ্ত ধাতুর লবণকে তুল্য পরিমাণ \mathrm{CaCO}_{3} এর সাপেক্ষে গণনা করা হয়।
24 g M g^{2+}, 40 g C a^{2+}, 56 g F e^{2+} জনিত খরতা দূর করার জন্য প্রতিক্ষেত্রেই 1 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{CO}_{3} প্রয়োজন।
\mathrm{CaSO}_{4}+\mathrm{Na}_{2} \mathrm{CO}_{3} \rightarrow \mathrm{CaCO}_{3}+\mathrm{Na}_{2} \mathrm{SO}_{4}এই বিক্রিয়া মতে,
1 \mathrm{~mol} \mathrm{CaSO}_{4} \equiv 1 \mathrm{~mol} \mathrm{CaCl}_{2} \equiv 1 \mathrm{~mol} \mathrm{CaCO}_{3} \equiv 100 \mathrm{~g} \mathrm{CaCO}_{3}একইভাবে,
1 \mathrm{~mol} \mathrm{MgCl}_{2} \equiv 1 \mathrm{~mol} \mathrm{MgSO}_{4} \equiv 1 \mathrm{~mol} \mathrm{FeCl}_{2} \equiv 1 \mathrm{~mol} \mathrm{CaCO}_{3}পানির খরতার মাত্রা নির্ণয় কর :
(ক) সাধারণ পদ্ধতি
(i) অস্থায়ী খরতা নির্ণয় : এক্ষেত্রে গৃহীত খর পানির নমুনাকে মিথাইল অরেঞ্জ নির্দেশকের উপস্থিতিতে প্রমাণ- HCl বা \mathrm{H}_{2} \mathrm{SO}_{4} দ্বারা টাইট্রেশন করে প্রাপ্ত ফলাফল থেকে অস্থায়ী খরতা পরিমাপ করা হয়।
পানিতে বাইকার্বনেট লবণ দ্রবীভূত থাকলে পানির অস্থায়ী খর হয়। তাই এক্ষেত্রে সংঘটিত বিক্রিয়া হলো ।
\mathrm{CaCO}_{3}+2 \mathrm{HCl} \rightarrow \mathrm{CaCl}_{2}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}\left[\mathrm{CaCO}_{3}=\mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2}\right]\mathrm{Ca}\left(\mathrm{HCO}_{3}\right)_{2} \rightarrow \mathrm{CaCO}_{3}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}
অতঃপর b V_{1} M_{1}=a V_{2} M_{2} দ্বারা ppm এককে \mathrm{CaCO}_{3}এর পরিমাণ নির্ণয় করা হয়।
এখানে, b=HCl এর মোল সংখ্যা, V_{1}= নমুনার আয়তন M_{1}= নমুনার ঘনমাত্রা, a=\mathrm{CaCO}_{3}এর মোল সংখ্যা, V_{2}=HCl এর আয়তন M_{2}=HCl এর ঘনমাত্রা।
(ii) স্থায়ী খরতা নির্ণয় : খর পানিকে ফুটিয়ে বাইকার্বনেটকে সম্পূর্ণরূপে কার্বনেটে পরিণত করে অধঃক্ষিপ্ত হয়। পানিতে অতিরিক্ত \mathrm{Na}_{2} \mathrm{CO}_{3} এর প্রমাণ দ্রবণ যোগ করা হয়। এই \mathrm{Na}_{2} \mathrm{CO}_{3} খর পানির উপাদানের সাথে বিক্রিয়া করে খরতা দূর করে, অতঃপর দ্রবণকে পরিস্রাবণ করে অধঃক্ষেপ অপসারণ করা হয়। পরিস্ফুত দ্রবণকে মিথাইল অরেঞ্জ নির্দেশক ব্যবহার করে প্রমাণ এসিড দ্রবর সাহায্যে টাইট্রেশন করা হয়।এর ফলে বিক্রিয়া শেষে অবশিষ্ট \mathrm{Na}_{2} \mathrm{CO}_{3} দ্রবনের আয়তন তথা পরিমাণ জানা যায়।
এ আয়তন অপরিবর্তিত \mathrm{Na}_{2} \mathrm{CO}_{3} দ্রবনের আয়তন নির্দেশ করে। প্রথমে ব্যবহৃত \mathrm{Na}_{2} \mathrm{CO}_{3} দ্রবণের আয়তন থেকে এ আয়তন বাদ দিলে পানিতে উপস্থিত লবণের সাথে কী পরিমাণ \mathrm{Na}_{2} \mathrm{CO}_{3} বিক্রিয়া করে তা পাওয়া যায়। \mathrm{Na}_{2} \mathrm{CO}_{3} এর পরিমাণ \mathrm{CaCO}_{3} এর পরিমাণ নির্ণয় করা হয়।
\mathrm{CaSO}_{4}+\mathrm{Na}_{2} \mathrm{CO}_{3} \rightarrow \mathrm{CaCO}_{3}+\mathrm{Na}_{2} \mathrm{SO}_{4} \mathrm{CaSO}_{4}+\mathrm{Na}_{2} \mathrm{CO}_{3} \rightarrow \mathrm{CaCO}_{3}+\mathrm{Na}_{2} \mathrm{SO}_{4}অর্থাৎ, 1 \mathrm{~mol} \mathrm{CaSO}_{4} \equiv 1 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{CO}_{3} \equiv 1 \mathrm{~mol} \mathrm{CaCO}_{3}
এক্ষেত্রেও b V_{1} M_{1} ≡ a V_{2} M_{2} দ্বারা পানিতে \mathrm{CaCO}_{3} এর পরিমাণ ppm এককে নির্ণয় করা যায়।
অথবা, 1000ml 1M \mathrm{Na}_{2} \mathrm{CO}_{3} \equiv 100 \mathrm{~g} \mathrm{CaCO}_{3}
\mathrm{CaCO}_{3} ছাড়া অন্য কোন কার্বনেট লবণ উপস্থিত থাকলে তুল্য ভরের নীতি অনুসরণ করে গণনা করা হয়।
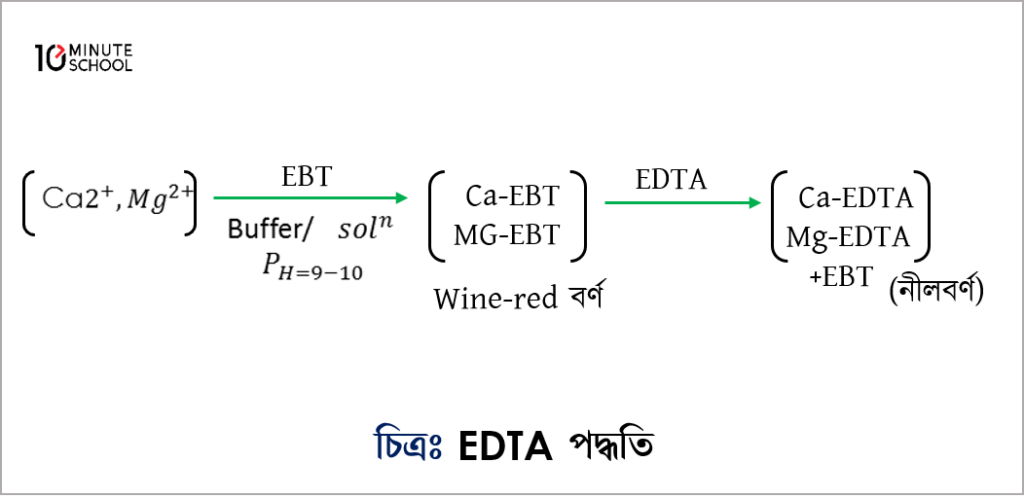
(খ) EDTA (Etylene Diamine Tetra Acetate) পদ্ধতি : এ পদ্ধতিতে সঠিক ও সহজে পানির মোট খরতা নির্ণয় করা যায়। এ পদ্ধতিতে নির্দেশক হিসেবে ইরিক্রোম ব্লক T (EBT) ব্যবহৃত হয়।
এ গঠন থেকে বুঝা যায় যে, EDTA এর সাথে \mathrm{Ca}^{2+} \text { এবং } \mathrm{Mg}^{2+} এর বিক্রিয়ায় মোল অনুপাত 1:1।
পদ্ধতি : বুরেটে EDTA এর ডাই Na লবণের প্রমাণ দ্রবণ নেয়া হয়। এবার নমুনা পানির একটি নির্দিষ্ট আয়তন কনিক্যাল ফ্লাক্সে নিয়ে তাতে 3-4 ml pH 10 এর বাফার দ্রবণ যোগ করা হয়। অতঃপর 2-3 ফোঁটা EBT নির্দেশক যোগ করা হয়। নমুনার পানি খর হলে পানির বর্ণ পাকা জাম বা red wine বর্ণের হয়। এরপর বুরেট থেকে প্রমাণ দ্রবণ যোগ করে টাইট্রেশন করা হয়। যে বিন্দুতে দ্রবণ নীল বর্ণ ধারণ করে সেখানে সমাপ্তি বিন্দু নির্দেশ করে।
গণনা :
এক্ষেত্রে b V_{1} M_{1}=a V_{2} M_{2} দ্বারা \mathrm{CaCO}_{3} এর পরিমাণ নির্ণয় করা যায় –
এখানে, a:b=1:1
V_{1}= নমুনা দ্রবণের আয়তন, M_{1}= নমুনা দ্রবণের ঘনমাত্রা
V_{2}=EDTA এর আয়তন, M_{2}= EDTA এর ঘনমাত্রা
অথবা পরীক্ষাধীন পানির খরতা =\frac{\text { নির্দিষ্ট ঘনমাত্রার } E D T A \text { এর আয়তন } \times 1000}{\text { নমুনা পানির আয়তন }} p p m (এককে নির্ণয় করা হয়)
এ পদ্ধতির সাহায্যে পানিকে ফুটিয়ে অতঃপর টাইট্রেশন করলে স্থায়ী খরতা নির্ণয় করা যায়।
∴ পানির অস্থায়ী খরতা = মোট খরতা – স্থায়ী খরতা
প্রশ্ন-২৫ : পানিতে DO এর পরিমাণ নির্ণয়ের পদ্ধতি লিখ।
উত্তর : উইঙ্কলার (Winkler) পদ্ধতিতে আয়োডোমিতি পদ্ধতি অনুসরণ করে অর্থাৎ এ পদ্ধতিতে DO দ্বারা ম্যাংগানিজ (ii) লবণকে জারিত করে ম্যাংগানিজ (iv) যৌগে পরিণত করা হয়। উৎপন্ন M n^{4+} যৌগের সাথে আয়োডাইড লবণের বিক্রিয়ায় যে আয়োডিন মুক্ত হয়। তাকে প্রমাণ \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3} দ্বারা টাইট্রেশন করে। পানিতে DO এর পরিমাণ নির্ণয় করা হয়। পদ্ধতিটি নিম্নরূপ :
- ক্ষারীয় জলীয় দ্রবণে \mathrm{MnSO}_{4} দ্রবণ যোগ করা হয়।
- পানির দ্রবীভূত \mathrm{O}_{2} \text { দ্বারা } \mathrm{Mn}(\mathrm{OH})_{2}জারিত হয়ে ক্ষারকীয় ম্যাংগানিজ অক্সাইড উৎপন্ন করে।
- এ অবস্থায় KI যোগ করে ঝাকানো হয় এবং \mathrm{H}_{2} \mathrm{SO}_{4} যোগ করে পুনরায় ঝাঁকানো হয়।
\mathrm{Mn}\left(\mathrm{SO}_{4}\right)_{2}+2 \mathrm{KI} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{MnSO}_{4}+I_{2}
বা, M n^{4+}+2 I^{-} \longrightarrow M n^{2+}+I_{2}
- প্রমাণ \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}দ্রবণের সাহায্যেমুক্ত I_{2} কে টাইট্রেশন করে DO এর পরিমাণ নির্ণয় করা হয়।
গণনা : বিক্রিয়া মতে,
O_{2} \equiv 4 I^{-} \equiv 2 I_{2} \equiv 4 N a_{2} S_{2} O_{3}
\therefore 1 \mathrm{~mol} \mathrm{O}_{2} \equiv 4 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}
বা, 1 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}=\frac{1}{4} \mathrm{~mol} \mathrm{O}_{2}=8 g \mathrm{O}_{2}
যদি YmL পরীক্ষাধীন পানির নমুনাকে টাইট্রেশন করতে M মোলারিটির N a_{2} S_{2} O_{3} দ্রবণের XmL প্রয়োজন হয় তবে,
\frac{V_{1} M_{1}\left(O_{2}\right)}{V_{2} M_{2}\left(N a_{2} S_{2} O_{3}\right)}=\frac{1}{4}বা, M_{1}=\frac{V_{2} M_{2}}{4 V_{1}}
অথবা, 1 m L 1 M N a_{2} S_{2} O_{3} \equiv 8 m g O_{2}
এ হিসাব থেকে PPM এককে O_{2} এর পরিমাণ নির্ণয় করা যায়।
প্রশ্ন-২৬ : পানির BOD নির্ণয়ের পদ্ধতি ব্যাখ্যা কর।
উত্তর : BOD পরিমাণের জন্য পরীক্ষার শুরুতে নমুনা পানিতে কিছু অণুজীব যোগ করে উপযুক্ত পরিবেশে (20℃) পাঁচ দিন রেখে দেয়া হয়। নমুনাকে পাঁচদিন আগে এবং পাঁচ দিন পরে Winkler পদ্ধতিতে DO নির্ণয় করে BOD নির্ণয় করা হয়।
(B O D)_{5}=\left(D O_{1}-D O_{2}\right) \times লঘূকরণ ফ্যাক্টর
\mathrm{DO}_{1}= পাঁচ দিন পূর্বে পানিতে DO এর পরিমাণ
\mathrm{DO}_{2}= পাঁচ দিন পূর্বে পানিতে DO এর পরিমাণ
লঘূকরণ ফ্যাক্টর=\frac{\text { লঘুকৃত নমুনার আয়তন }}{\text { অলঘুকৃত নমুনার আয়তন}}
প্রশ্ন-২৭ : পানিতে DO কমে যাওয়ার কারণগুলো উল্লেখ কর। DO এর মান কোন কোন বিষয়ের উপর নির্ভরশীল?
উত্তর : (i) জলজ প্রাণী ও উদ্ভিদের সালোকসংশ্লেষণ ও শ্বসনের হার
(ii) পানির তাপমাত্রা
(iii) বিভিন্ন পদার্থের জারণ প্রভৃতি বিষয়ের উপর DO এর মান নির্ভরশীল।
প্রশ্ন-২৮ : পানিতে COD নির্ণয়ের পদ্ধতি বর্ণনা কর।
উত্তর : COD নির্ণয়ের ধাপসমূহ নিম্নরূপ –
(i) একটি কনিক্যাল ফ্লাস্কে নমুনা পানি সংগ্রহ করা হয়।
(ii) নমুনা পানির মধ্যে অতিরিক্ত পরিমাণ 0.1 M K_{2} C r_{2} O_{7} দ্রবণ এবং গাঢ় \mathrm{H}_{2} \mathrm{SO}_{4} মিশ্রিত করে মিশ্রণে
1 \mathrm{~g} \mathrm{Ag}_{2} \mathrm{SO}_{4} ও 1 \mathrm{~g} \mathrm{HgSO}_{4} যোগ করা হয়। এক্ষেত্রে \mathrm{Ag}_{2} \mathrm{SO}_{4} প্রভাবক হিসেবে এবং \mathrm{HgSO}_{4} \text { কে } \mathrm{Cl}^{-} আয়ন দূর করতে ব্যবহৃত হয়।
(iii) মিশ্রণকে প্রায় ৪-৫ ঘণ্টা যাবত রিফ্লাক্স করা হয়।
\left[\mathrm{CH}_{2} \mathrm{O}\right]+\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{Cr}_{2}\left(\mathrm{SO}_{4}\right)_{3}+\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2}বা, 3\left[\mathrm{CH}_{2} \mathrm{O}\right]+16 \mathrm{H}^{+}+2 \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-} \rightarrow 4 \mathrm{Cr}^{3+}+3 \mathrm{CO}_{2}+7 \mathrm{H}_{2} \mathrm{O}
(iv) দ্রবণকে শীতল করে বিক্রিয়ায় অব্যবহৃত কে ফেরোইন (Ferroin) নির্দেশকের (সবুজ ভিট্রিওল
এবং ফেনানথ্রোলিন নামক জৈব যৌগের মিশ্রণ) উপস্থিতিতে \mathrm{H}_{2} \mathrm{SO}_{4}এ দ্রবীভূত 0.1 M মোর লবণের সাহায্যে টাইট্রেশন করা হয়।
(v) অতঃপর blank টাইট্রেশন করা হয়।
\therefore C O D=\frac{\left(v_{1}-v_{2}\right) \times M \times 8 \times 1000}{v} m g L^{-1}এখানে , V_{1}=পানির নমুনা ছাড়া বাকী মিশ্রণকে তথা blank টাইট্রেশন ব্যবহৃত মোর লবণ (FAS) এর আয়তন।
V_{2}= পরীক্ষণীয় বানমুনা টাইট্রেশনে ব্যবহৃত মোর লবণ (FAS) এর আয়তন।
M= FAS এর ঘনমাত্রা
V= পরীক্ষার জন্য গৃহীত নমুনার আয়তন
8=O_{2} এর তুল্য ভর।
প্রশ্ন-২৯ : BOD ও COD এর অনুপাত হতে কি ধারণা পাওয়া যায় ?
উত্তর : \frac{B O D}{C O D} এর মানের অনুপাত 0.6 এর বেশি হলে ঐ পানি সহজে জীব ভাঙ্গনযোগ্য বা জৈব দূষিত বা বিয়োজন যোগ্য। যদি এই অনুপাত 0.3-0.6 এর মধ্যে হয় তাহলে তা জীবভাঙ্গনযোগ্য নাও হতে পারে। কিন্ত এই অনুপাতে 0.3 এর কম হলে এই পানি সবচেয়ে বেশি দূষিত এবং এই দূষণ অনেকক্ষেত্রে দুরীকরণ সম্ভব।
প্রশ্ন-৩০ : পানির BOD এর মান অপেক্ষা COD এর মান বেশি হয় কেন ?
উত্তর : COD এর ক্ষেত্রে Bio-degradable এবং Non-biodegradable উভয় প্রকার দূষক জারিত হয়। এক্ষেত্রে প্রয়োজনীয় O_{2}এর পরিমাণ বেশি হয়। অপরদিকে BOD তে শুধুমাত্র জীব ভাঙ্গনযোগ্য পদার্থসমূহ বা bio-degradable জারিত হয়। ফলে এক্ষেত্রে প্রয়োজনীয় O_{2} এর পরিমাণ কম হয়। এ কারণে BOD অপেক্ষা COD এর মান বেশি হয়।
প্রশ্ন-৩১ : TDS হ্রাস করার উপায়গুলো উল্লেখ কর।
উত্তর : TDS হ্রাস করার উপায়গুলো নিম্নে দেওয়া হল –
(i) ফিল্টার পদ্ধতি
(ii) কার্বন-ছাঁকন পদ্ধতি
(iii) পাতন পদ্ধতি
(iv) Deinonigation বা আয়ন বিমুক্তকরন পদ্ধতি
প্রশ্ন-৩২ : বিভিন্ন প্রকার শিল্প বর্জ্যগুলোর উৎস এবং এর সমস্ত বর্জ্য পদার্থগুলো কিরূপে পানি দূষণ করে তা ব্যাখ্যা কর।
উত্তর :
(i) ক্লোরিন-ক্ষার শিল্প : এ শিল্প থেকে সৃষ্ট বর্জ্য পানির রং নষ্ট করে, ক্ষমতা বৃদ্ধি করে এবং DO এর পরিমাণ হ্রাস করে।
(ii) কাঁচ এবং সিরামিক শিল্প : এ বর্জ্যের ফলে পানি দুর্গন্ধযুক্ত হয়। pH ও DO এর মান হ্রাস পায়।
(iii) সিমেন্ট শিল্প : এর থেকে সৃষ্ট বর্জ্য পানির তাপমাত্রা বৃদ্ধি করে। DO হ্রাস পায়, পানিকে দূষিত করে।
(iv) সাবান ও ডিটারজেন্ট শিল্প : এর ফলে পানি দুর্গন্ধযুক্ত হয়। স্বাভাবিক রং নষ্ট হয়। BOD, COD বৃদ্ধি পায় এবং এই ধরণের পানিতে শৈবাল জাতীয় উদ্ভিদের পরিমাণ বৃদ্ধি পায়।
(v) কাগজ ও মন্ড শিল্প : এ থেকে সৃষ্ট বর্জ্য পানির রং নষ্ট করে। pH মান ও DO এর মানের পরিবর্তন ঘটায়।
(vi) চামড়া শিল্প : এ থেকে সৃষ্ট বর্জ্য পানিকে দুর্গন্ধযুক্ত করে তোলে। BOD ও COD এর মান বৃদ্ধি পায়। ক্রোমিয়াম বিসাক্ততা ঘটায়।
(vii) ইলেক্ট্রোপ্লেটিং শিল্প : এ শিল্প হতে সৃষ্ট বর্জ্যগুলো পানিতে TDS এর পরিমাণের বৃদ্ধি ঘটায়। এ সমস্ত বর্জ্যের উপস্থিতির ফলে জলজ উদ্ভিদের সালোকসংশ্লেষণ প্রক্রিয়ার বিঘ্ন ঘটে।